健康知识库
主动脉夹层
编辑:ddayh.cn
主动脉夹层的识别及诊治,专家支招!|临床必备
?
急性冠脉综合征、急性肺栓塞、主动脉夹层(AD)和气胸被称为急危重症、急性胸痛的四大“陷阱”。在临床实践中应如何识别AD?又该如何诊治?
AD的定义和分期
1. 定义
主动脉夹层(AD):内膜撕裂,血液被压入主动脉中层(产生假腔),占62%-88%。
壁内血肿(IMH):滋养血管破裂,产生并不与主动脉腔相交通的血肿,占主动脉综合征的6%,临床上等同于AD。
穿透性溃疡(PU):动脉粥样硬化斑块穿透弹力层,中膜出血,占10%-30%。
2. 分期
根据病程长短可将AD分为超急性期(30天)。
AD分型和总体预后
目前临床上常用的AD分类方法主要有DeBakey和Stanford两种分型方法。DeBakey分型将AD分为三种类型,其分型的依据是AD撕裂的位置和夹层沿主动脉扩展的情况:I型是指夹层的原发破口起源于升主动脉并向远端主动脉弓和降主动脉撕裂和延伸;Ⅱ型是指夹层的原发破口起源升主动脉,其撕裂和延伸局限于升主动脉内;Ⅲ型,夹层的原发破口起源于左侧锁骨下动脉开口远端的降主动脉,并向远端撕裂和延伸,可累及胸主动脉和腹主动脉,其中Ⅲa为夹层累及到近端降主动脉;Ⅲb为夹层累及远端降主动脉和腹主动脉。
Stanford分型将AD分为A和B两种类型,其分型依据为是否累及升主动脉。Stanford A型累及升主动脉的夹层(近端AD),相当于DeBakey分型中的I和II型,其发生率为62%,患者预后较差,药物治疗时死亡率为58%,手术治疗时死亡率可降至26%。Stanford B型夹层累及左锁骨下动脉开口以远的降主动脉(远端AD),相当于DeBakey分型中的Ⅲ型,其发生率为38%,患者预后相对较好,药物治疗时死亡率为10.7%,手术治疗时死亡率为31%,因此一般进行药物治疗。AD总体死亡率为27.4%。
AD的危险因素
1. 老年患者的经典危险因素
年龄(平均年龄为60-70岁)、高血压(70%以上的动脉夹层有高血压史)、性别(男性约70%)、吸烟、高脂血症、血压急性上升(可卡因、 Valsalva 动作)。
2. 遗传和获得性易感性
(1)结缔组织病是<40岁发病年龄组最重要的危险因素,如马凡氏综合征、Ehlers-Danlos IV型、Loegys-Dietz综合征、主动脉瓣环扩张、家族性主动脉夹层、多囊性肾病。
(2)先天性主动脉异常:主动脉瓣叶式畸形患者A型和B型AD的发病率分别为2%-9%和3%;约1%的主动脉缩窄患者会出现胸主动脉AD,但Turner氏综合征患者的胸主动脉夹层发病率并不确切。
(3)主动脉炎,如大动脉炎,巨细胞性动脉炎,白塞氏病,结核和梅毒。
(4)妊娠,如怀孕第三期。
(5)长期应用糖皮质激素和/或免疫抑制剂。
3. 创伤
钝性伤、减速伤、主动脉内球囊反搏(IABP)、心脏或主动脉手术、心导管检查。
病史、临床表现和客观检查
1. 病史和临床表现
患者的症状和体征与受累血管分支和远端器官相关,可随夹层进展而改变,如表1。
表1 AD患者的病史和临床表现??
近10%的AD患者不表现为疼痛。临床上,病史采集获得内容的敏感性和特异性均较差。所有胸部钝性伤后有胸痛或背痛的患者均应考虑AD。患者应首先检查双侧血压和桡动脉的对称性。若双上肢收缩压差>20 mmHg(敏感性低),则应高度怀疑AD。
2.客观检查
(1)心电图
近端AD可影响右冠状动脉,4%-8%的AD表现为ST段抬高的下壁心梗。下壁心梗患者一定要考虑近端AD。
(2)胸片
AD患者的胸片异常可表现为纵膈增宽,左胸腔积液。总体来讲,20%的AD患者胸片正常,因此胸部X线检查不能用于排除夹层。
(3)超声心动图
经胸超声心动图诊断A型和B型主动脉夹层敏感性分别为78%-100%和31%-55% 。经食道超声心动图(TEE) 诊断近端AD的敏感性> 95%,诊断远端AD的敏感性为80%。TEE还可评估冠状动脉、心包和主动脉返流;也可观察到气管后的盲点。
(4)CT
CT具快速,无创,易于进行等优点。CT平扫+增强诊断AD的敏感性≥93%,特异性98%,是诊断AD最可靠的检查。但是如果临床高度怀疑急性主动脉综合征,而CT结果阴性,则需要进行进一步检查。
(5)主动脉造影
敏感性约90%,费时,无法检测IMH,但可评估血管分支。
(6)D-二聚体
敏感性或阴性预测值为97%。最近的荟萃分析结果表明,对于低危患者,D-二聚体阴性对排除AD有用,但不能用于高危患者。D-二聚体阴性不能排除IMH。
D-二聚体正常,AD风险积分<2,可用于排除AD;D-二聚体正常,AD风险>2,敏感性降低,特异性大大降低,如表2和表3。
表2 AD风险评分??
表3 D-二聚体和AD风险积分?
AD的冶疗进展
1. 初始治疗:降低dP/dt,目标心率为60 bpm,收缩压100-120mmHg或降至保留微循环水平灌注的最低血压水平;排除假性低血压,如由于锁骨下夹层导致的手臂血压降低;血压的读数应该以高的一侧为准。
2. 静脉应用-受体阻断剂(如普萘洛尔,艾司洛尔,拉贝洛尔),以对抗血管扩张剂反射性地引起心率增加作用。若患者有β受体阻断剂的禁忌证,则用维拉帕米或地尔硫卓替代。
3. 随后,用血管扩张剂(如硝普钠)以降低收缩压。
4. 必要时,可用吗啡控制疼痛,以减少交感神经活性。
5. 如果出现低血压,则需进行血管外科紧急会诊;通过静脉补液保持有效的循环量;运用血管加压药保持平均动脉压(70 mmHg);并排除心包填塞、夹层破裂、严重主动脉瓣返流等并发症。
对于近端AD(所有急症或慢性进行性发展病变、合并主动脉返流或动脉瘤),需以外科手术(主动脉根部置换)为治疗主线。对于远端AD,需以内科药物治疗为主。除外AD进行性发展,或动脉分支受累引起灌注不良、缺血,顽固性高血压,顽固性疼痛,动脉瘤大小、假腔大小迅速发展。另外,远端AD还需进行重复的成像检查,可在常规(如7天、3周,然后每年)及有任何临床或显著实验室变化时进行。如果有合并症,腔内修复术(包括支架、封堵入口、开放闭塞的分支)等在降低死亡率方面或优于外科手术。急性AD的外科,腔内和药物治疗适应证,如表4。
表4 急性AD的外科,腔内和药物治疗适应证?
AD的并发症
AD并发症的发生率为20%。在临床中,需密切观察患者的症状、血压、脉搏和尿量等生命体征,以及肌酐、血红蛋白和乳酸等实验室检查值。若患者有难以控制的血压、持续的疼痛,则提示并发症或夹层的延展。
AD破裂时,血液聚集在心包,可出现心包填塞(应避免心包穿刺,除非休克或无脉电活动);若血液聚集在胸腔、纵隔、腹膜后,血肿增大可预示破裂。AD可导致灌注不良(部分或全部阻塞动脉分支),可以是静态(撕脱/血栓),也可以为动态( 真腔与假腔压力改变)。AD还可导致主动脉瓣返流,这是由于瓣环扩张或破裂,或瓣叶由假腔取代所致。
AD的前期死亡率和随访时间
前48小时,急性近端病变的死亡率为每小时1%-2%;急性远端病变前30天的死亡率为10%。前1、3、6月需进行AD随访,之后每年随访。在随访时,应先进行CT随访,之后可用MRI进行随访,以降低射线暴露的积累量。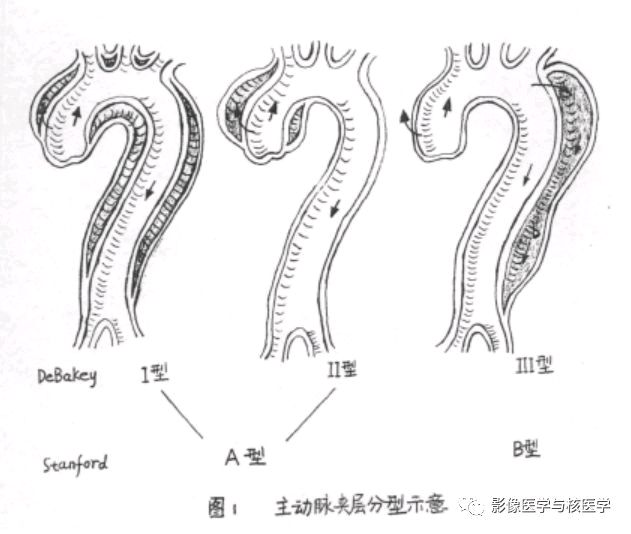
- 上一篇:非小细胞肺癌手术方式介绍
- 下一篇:华法林~灭鼠药
- 200浅谈先天性心脏病治疗的误区(一
- 200新冠肺炎三阶段
- 200肺大疱的鉴别诊断
- 200胸壁结核的临床表现
- 199胸痛!你有!我有!好像大家有!
- 199你是不是肺癌高危人群呢?
- 199心脏手术术后注意事项
- 199月经性气胸---特殊发病机制---注
- 199什么是肺结节?如何发现肺结节?
- 199单纯性气胸和隐性气胸。
- 199钝性膈肌损伤的症状和体征
- 197胸骨骨折不容小觑
- 197肺肿瘤标志物
- 197手足汗症
- 197贤医还是侠医?
- 196支气管袖式成型术治疗中央型非小
- 196如何应对肺部结节?
- 196保守丰胸方法
- 196别人放弃的手术
- 196胸痛,这个病不可忽略,主动脉夹
热门胸外科