健康知识库
双剑合璧——T+A靶向免疫新疗法降低肝癌死亡风险,将成为晚期肝癌患者一线治疗
编辑:ddayh.cn
- 200乳腺癌内分泌治疗
- 200副作用治疗
- 200胃癌患者术后注意事项
- 2002017年肺癌TNM分期
- 200非小细胞肺癌的四代EGFR-TKI靶向
- 200史上最全靶向治疗及免疫治疗大盘
- 200免疫治疗最全、最实用科普!
- 200肿瘤科普文章系列一:三分钟带你
- 200T-spot结核鉴别
- 200食品、补品或药品,都要一个度~
- 200癌症筛查怎么做
- 200每个人体内都有原癌基因和抑癌基
- 200乳腺的一生原来是这个样子的……
- 200你可能误会肿瘤了
- 200血友病是一种遗传性的,由于凝血
- 200腋下淋巴癌早期症状
- 200胃良性肿瘤如何鉴别诊断
- 200怎么样自我检查口腔癌
- 200产后得宫颈癌的原因有哪些
- 200胃窦癌症状和治疗方法
导语:5月14日《新英格兰医学杂志》(NEJM)发表了一项针对晚期不能手术切除的肝细胞癌的3期临床试验(T+A靶向免疫治疗)IMbrave150研究结果,阿替利珠单抗联合贝伐珠单抗将成为晚期肝癌一线治疗的新疗法。
2020年,注定是不平凡的一年!新冠病毒的大流行,让中国人民都陷入传染病的恐慌之中,对人民的生命安全造成了严重的威胁。然而,作为全球发病率排名第六的恶性肿瘤,肝癌在中国每年的发病数为46.6万,是新冠肺炎的5倍;死亡为42万,是新冠肺炎的90倍,成为了严重威胁人民群众生命健康的顽疾。
2020年5月14日,也就是几天前,肝癌治疗领域也发生了一件具有里程碑意义的大事件——《新英格兰医学杂志》(NEJM)发表了一项肝细胞癌的3期临床试验IMbrave150结果[1]。这项研究关乎全世界百万肝癌患者的性命,因为它在未来将改变不能手术切除的晚期肝癌的一线标准治疗。阿替利珠单抗联合贝伐珠单抗这一双剑合璧的靶向免疫治疗新疗法,与目前标准的一线治疗索拉非尼相比,能降低晚期肝癌患者42%的死亡风险!
我先和广大癌症病友们介绍下这两个药物。
阿替利珠单抗是PD-L1抗体,属于免疫治疗药物。与PD1抗体类似,通过阻断T淋巴细胞的PD-1及肿瘤细胞的PD-L1结合,激活免疫T细胞识别并且杀伤肿瘤细胞,达到治疗的目的。在早期的临床试验中,阿替利珠单抗也曾单独对晚期肝细胞癌进行过一线治疗,但是单药治疗效果并不理想,研究者也因此果断停止了对单用阿替利珠单抗的探索。
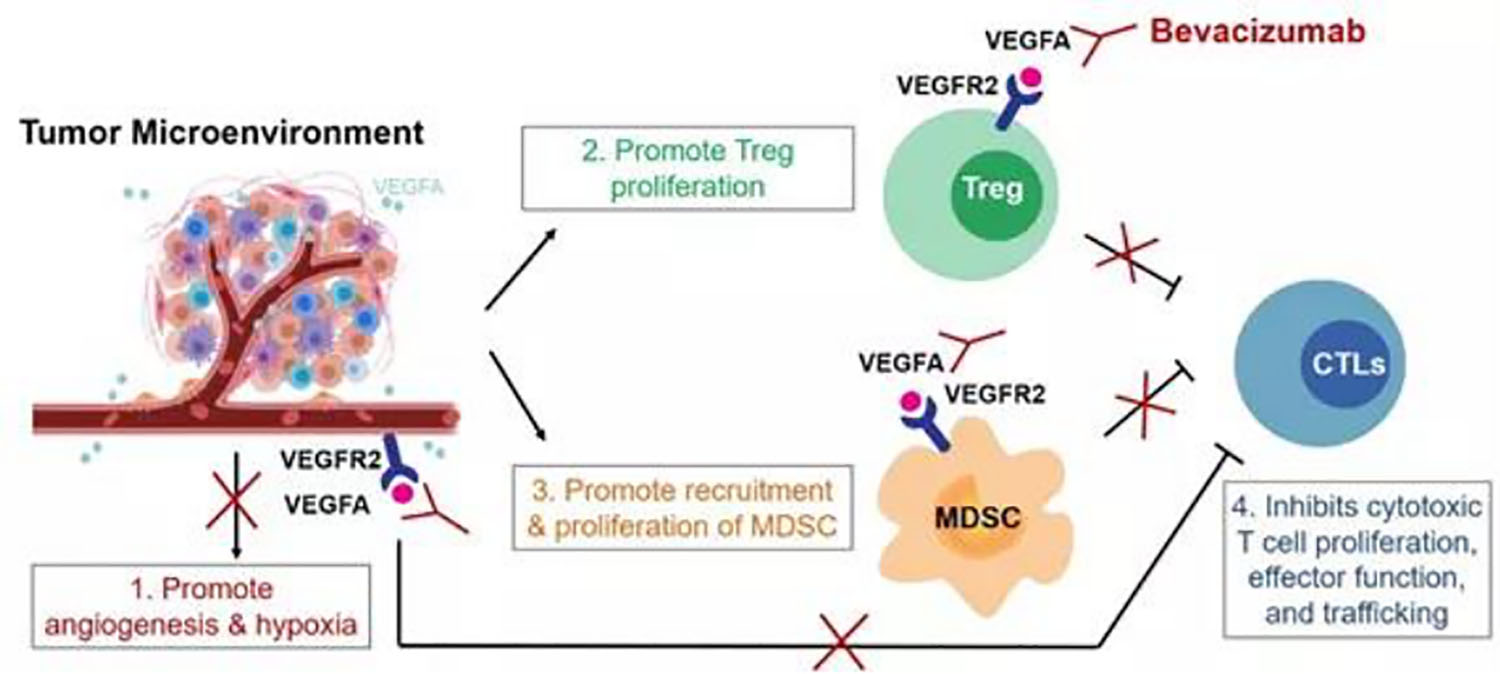
贝伐珠单抗是一种血管生成抑制剂(VEGF抗体),既往主要用于晚期转移性结直肠癌的靶向治疗。贝伐单抗能够通过阻断肿瘤VEGFA/VEGFR2通路,不仅能够抑制肿瘤新生血管生成,还能够抑制肿瘤诱导的调节性T细胞增殖,并通过抑制肿瘤表达的VEGF信号克服其诱导的肿瘤免疫抑制,与阿替利珠单抗联用能够大大提高抗肿瘤治疗疗效。
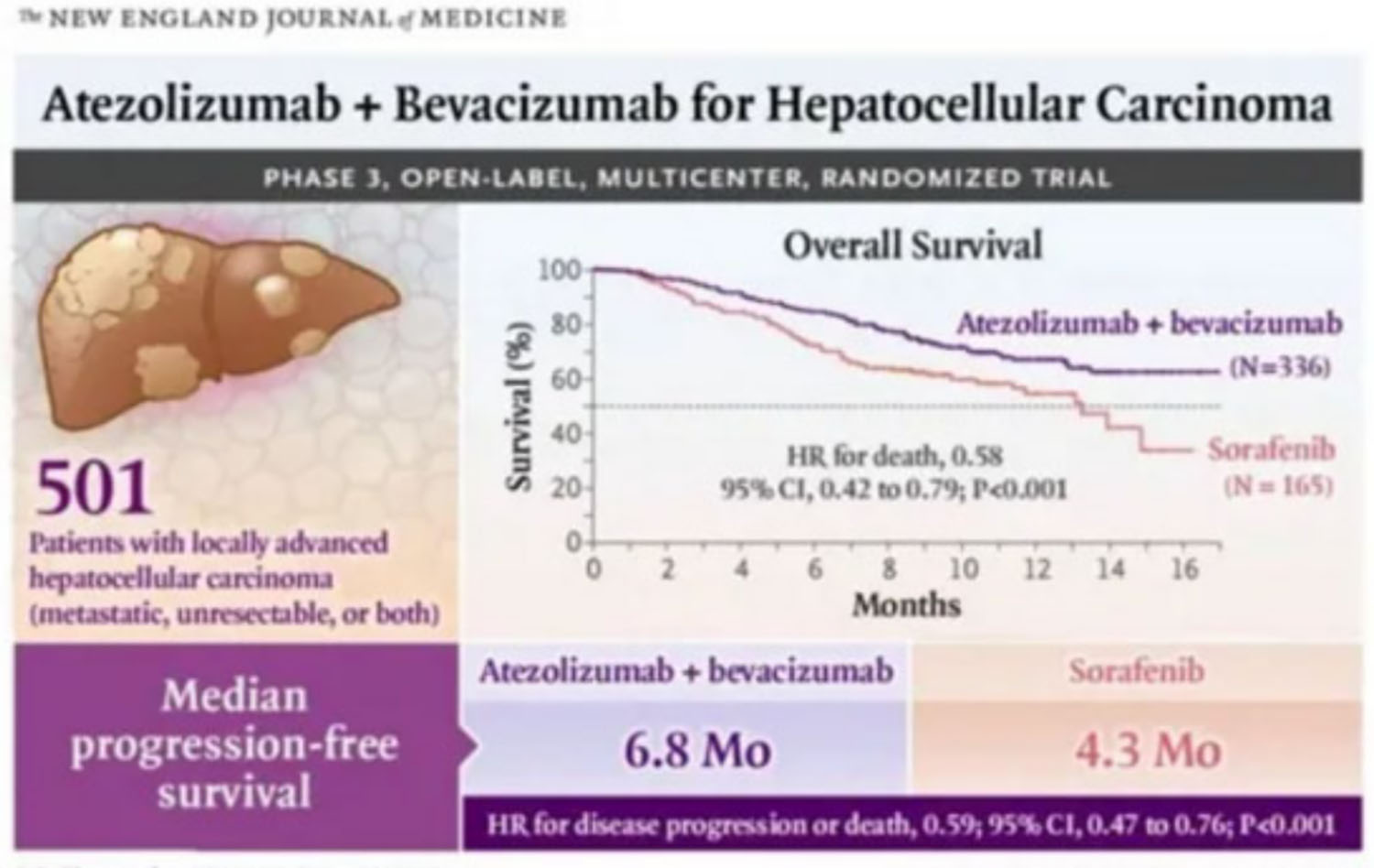
2016年开始的GO30140临床试验,研究者对晚期肝细胞癌患者采用阿替利珠单抗联合贝伐珠单抗(T+A方案)一线治疗。研究人员发现,联合治疗在客观缓解率和无进展生存期等方面都有出色表现。T+A方案一线治疗不可切除肝癌患者的客观缓解率为36%,其中有12%是完全缓解,患者的中位生存期达到17.1个月,12个月生存率高达63%。基于这一结果,科研团队于2018年开展了全球多中心3期临床试验IMbrave150研究[1]。
接下来让我们看一看刚刚在新英格兰杂志发表的IMbrave150研究的研究数据吧!
IMbrave150试验是一项跨国多中心的Ⅲ期试验,总共入组了501例患者,按照2:1的比例分配到T+A免疫联合治疗组和索拉非尼单药治疗组。 与索拉非尼相比,阿替利珠单抗与贝伐珠单抗免疫联合疗法使得患者死亡风险降低42%,同时使得疾病恶化或死亡风险降低41%,
研究发现,索拉非尼组的中位OS约13个月,而阿替利珠单抗+贝伐珠单抗组的死亡风险显著下降42%。而在本次NEJM正式刊发的论文中,揭晓了备受瞩目的患者12个月生存率(12 Month OS%)数据:T+A免疫联合治疗组患者,12个月生存率达到67.2%。这一数据,也成功突破了不可切除肝癌一线治疗生存期的瓶颈。
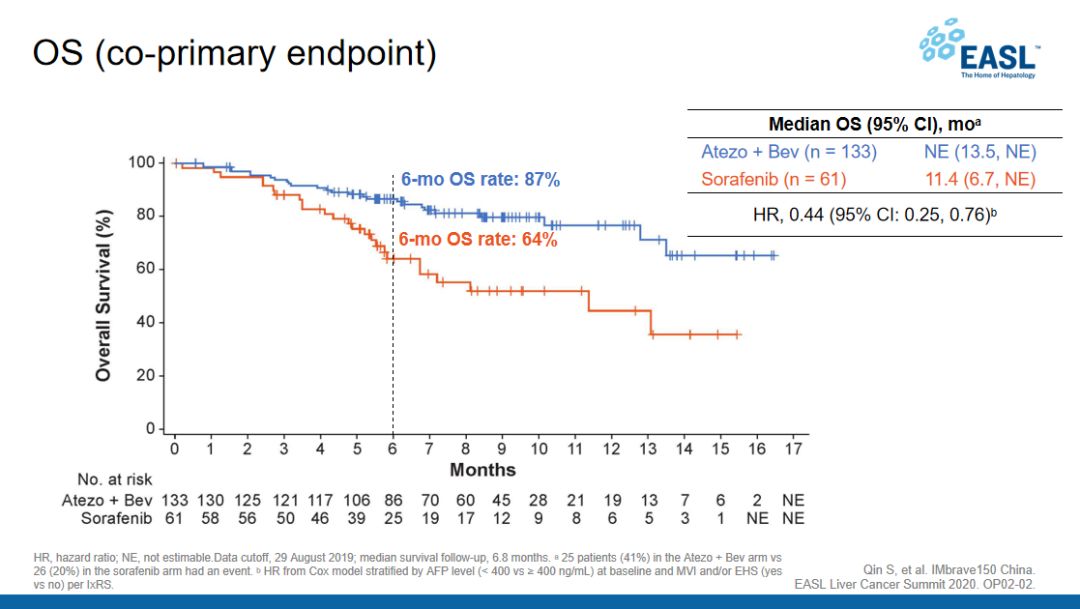
此外今年初的欧洲肝脏研究协会(EASL)肝癌峰会上,IMbrave150试验中国亚组的数据,也提示T+A可能会更适合中国患者的治疗,这项分析中包括了194例中国患者,结论相当具有说服力。
2018年,美国食品药品监督管理局(FDA)授予“T+A”免疫联合疗法(泰圣奇?联合安维汀?)治疗肝细胞癌突破性疗法认定。2020年,罗氏就“T+A”免疫联合治疗(泰圣奇?联合安维汀?)用于一线治疗晚期不可切除的肝细胞癌向中国国家药品监督管理局提交上市申请并获得优先审评资格。2020年V1版《NCCN肝胆癌临床实践指南》在肝癌一线治疗新增推荐T+A方案治疗不能手术切除的晚期肝细胞癌患者。
?IMbrave150研究是肝癌治疗的一个划时代的进展,是晚期肝癌一线治疗的重大突破。T+A疗法有望成为全球首个获批的肝癌一线靶向联合免疫疗法,为更多晚期肝癌患者带来福音。?
声明:?本文提及的阿替利珠单抗?(泰圣奇)及贝伐珠单抗(安维汀)肝癌适应症尚未在中国获批。图片来源于网络,若有侵权,可联系删除。
参考文献
1. Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med 2020;382:1894-905.
热门肿瘤外科