健康知识库
先天性就没有水管,你怎么射精怀孕
编辑:ddayh.cn
-
导致梗阻性无精的重要原因-
先天性输精管缺如
先天性输精管缺如(CAVD)是梗阻性无精子症的主要原因,占男性不育的1-2%。 CAVD既可作为健康男性的单纯表型特征,也作为囊性纤维化(CF)的表型之一。 CAVD分为先天性双侧输精管缺如(CBAVD),先天性单侧输精管缺如(CUAVD)或输精管先天性双侧部分性发育不全(CPAVD),偶尔合并有肾脏异常。 然而,CAVD的不同亚型是由某些基因中的相同遗传缺陷引起的。
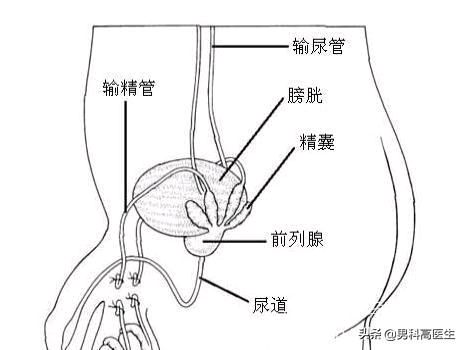
囊性纤维化跨膜传导调节因子(CFTR)基因(OMIM 602421)的突变是常染色体隐性遗传模式,被认为是大多数CAVD的病例的原因。 CFTR含有27个外显子并编码囊性纤维化跨膜传导调节因子,ATP结合盒(ABC)转运蛋白超家族成员,在精子附睾成熟和获能过程中发挥氯离子和碳酸氢盐稳态的重要作用。除此之外,粘附G蛋白偶联受体G2(ADGRG2)基因(OMIM 300572)是另一种CAVD致病基因,并具有X连锁遗传模式。该基因编码粘附G蛋白偶联受体G2,它是粘附型G蛋白偶联受体(粘附-GPCRs)超家族的成员,其在输精管内特异性表达。 ADGRG2基因的突变可能通过伴有精子停滞的睾丸中的液体积聚导致梗阻性无精子症。
在白种人中,78%的CBAVD患者至少有一个CFTR突变,最常见的突变是F508del,c.1210-12T [5](5T)和R117H(c.350G> A)(Yu等, 2012)。然而,在亚洲人群CFTR基因的先前突变分析中,在台湾36%的患者至少有一个突变CFTR等位基因,在印度为52%,在日本为58%,在国内为60%-63%。目前很少有人对亚洲人或国人的常见突变和CFTR遗传谱以及与CAVD相关的ADGRG2基因的全面研究来解释这些差异。
今天分享的文献是来自国内中山孙逸仙纪念医院的王文军教授团队发表在ANDROLOGY杂志上的一项研究。该研究共纳入了72名CAVD患者,包括了CAVD三个亚型:CBAVD,CUAVD和CPAVD,检测CFTR和ADGRG2基因的所有外显子,进一步理解中国CAVD患者的CFTR基因型谱。此外,将该中心的CAVD数据与中国CF患者的CFTR基因型进行比较,以分析突变率和可能的基因型差异。
研究结果:
CAVD患者的年龄范围为22至47岁(平均32.07岁)。 在这些患者中,总睾丸体积血清激素水平和抑制素B均正常,但精液量,精液pH,精液果糖和中性α-葡萄糖苷酶均降低(参考下限分别为1.5 mL、pH 7.2、每次射精13 umol、每次射精20 mU)。 在72名CAVD患者中,50名患有CBAVD(其中一名患有右侧异位肾脏),21名患有CUAVD,1名患有CPAVD,并进行完整的生殖器特征评估。
在72名患者的CFTR基因中共发现28种不同的突变,其中5种是新的[c.579 + 4T> C,c.1210-6T> A,c.1231A> G(p.Lys411Glu), c.1669T> A(p.Ser557Thr)和c.2042A> T(p.Glu681Val)]。 55名患者(76.39%,55/72)至少有一个CFTR突变,包括c.1210-12T [5](5T)变异(36.81%,53/144),这是最高的等位基因频率。 我们研究中的变体。 第二种最常见的突变(6.94%,10/144)是c.4056G> C(p.Gln1352His),第三高等位基因频率(3.47%,5/144)属于c.1666A> G(p。 Ile556Val)(表4)。 58.33%(42/72)CAVD患者CFTR基因有两个突变,18.06%(13/72)只有一个突变,23.61%(17/72)没有突变。
我们选择30名CAVD患者(13名至少有一名突变的患者和17名没有CFTR突变的患者)进行CFTR基因的MLPA分析。 然而,未发现缺失或重复(小插入缺失)。 检测到ADGRG2基因中的三种新变体[c.2312A> G(p.Asn771Ser),c.2452A> T(p.Lys818 *)和c.3023G> A(p.Arg1008Gln)]。 我们进一步检查了224名健康对照受试者,发现与我们的对照和外显子聚集联盟和1000个基因组数据库相比,缺少7个新突变或频率极低,但c.2312A> G(p.Asn771Ser)的等位基因频率为>5%,对照组为> 1%。
使用Clustal X(1.81,http://www.clustal.org/)将CFTR和ADGRG2蛋白跨物种比对,表明新突变的位置在六个不同物种中高度保守。预测CFTR基因中的c.1231A> G(p.Lys411Glu)和c.1669T> A(p.Ser557Thr)突变受到SIFT和突变品系分析的破坏,并且破坏了ABC转运蛋白核苷酸结合域,其归类为根据2015年ACMG标准和指南可能致病。预计CFTR基因中的c.2042A> T(p.Glu681Val)受到SIFT,PolyPhen-2和Mutation Taster分析的破坏,并破坏CFTR调节区域,其也被归类为可能的致病性。预计ADGRG2基因中的c.3023G> A(p.Arg1008Gln)受到SIFT和PolyPhen-2的破坏,并且在蛋白质的C末端附近被分类为可能的致病性。 c.2312A> G(p.Asn771Ser)变体通过SIFT,PolyPhen-2和Mutation Taster进行分析,并将其归类为良性。预计ADGRG2中的一个无义突变[c.2452A> T(p.Lys818 *)]会引入过早终止密码子,在ADGRG2蛋白的C末端截短199个氨基酸,并被归类为致病性。根据NetGene2软件,预计CFTR中的两个剪接位点突变会延长外显子5并截短外显子10。
据报道,与I556,S557或Q1352相邻的残基,例如G551D和G1349D,会干扰三磷酸腺苷(ATP)结合和核苷酸结合结构域(NBD)二聚化。因此,我们通过比较建模构建了磷酸化的ATP结合形式的人CFTR的结构,以探索这些突变的分子机制。尽管I556,S557和Q1352不直接参与ATP结合或NBD1-NBD2相互作用,但它们在维持CFTR的活性构象中起重要作用。 I556残基与I497,I502,I506,L526,L548和I556形成疏水簇。I556V突变具有较小的侧链,其削弱疏水相互作用,使结构不稳定,并可能进一步减少NBD1和ATP之间的接触。另一方面,S557T突变扩大了其侧链体积,并可能引入额外的空间位阻以降低蛋白质稳定性。 Q1352与H1348和H1375氢键结合并限制它们的位置和构象。这两个组氨酸残基与ATP中的磷酸基团形成强烈的静电相互作用,促进ATP结合。 Q1352突变为H引入另一个带正电荷的残基,其排斥H1348和H1375并削弱ATP结合。
中国CAVD患者的遗传谱显示,最常见的突变依次为5T,p.Ile556Val和p.Gln1352His(突变等位基因计数分别为175,65和19),最常见的突变类型是 错义突变(68.68%)。 然而,c.1766 + 5G> T是中国CF患者中最常见的突变,无义突变是最常见的突变类型。 迄今为止,ADGRG2基因中存在8个与CAVD患者相关的突变,并且无义和移码突变是主要类型。
本研究报道了中国CAVD患者中CFTR和ADGRG2基因的7个新突变。目前的研究结果表明,超过75%的CAVD患者具有CFTR突变,其中CBAVD占80%,这表明在CFTR和随后的ADGRG2中筛选所有外显子的重要性。该研究还阐述了中国CAVD患者的遗传谱和最常见的突变(c.1210-12T [5],I556V和Q1352H),这些突变与白种人和中国CF患者不同。此外,在中国CAVD患者中,最常见的突变类型是错义突变(68.68%),而在中国CF患者中,c.1766 + 5G> T和无义突变是最主要的,这可能解释了两者之间的不同表型。通过鉴定与中国CAVD患者相关的新的遗传缺陷谱,基因型 - 表型相关性将在这一相当数量的个体的管理和遗传咨询中是有价值的。
图片来源于andrology杂志
参考文献:
P. Yuan , Z. K. Liang, H. Liang et al. Expanding the phenotypic and genetic spectrum of Chinese patients with congenital absence of vas deferens bearing CFTR and ADGRG2 alleles. 2019 Feb 27. doi: 10.1111/andr.12592.
- 上一篇:伟哥的到来,不是每个男人都能用的
- 下一篇:人到中年万事休
- 200包皮手术,你该怎么选择?
- 200阴茎里面疼怎么回事
- 200什么情况下需要做包皮手术,看看
- 200小儿尿频莫担心
- 200包皮术后并发症处理及护理
- 200前列腺增生的健康指导
- 200早泄怎么锻炼
- 200男人得了淋病别着急,看了这篇文
- 200早泄的自我评估及行为治疗
- 200功能性阳痿 阳痿分为功能性阳痿
- 200教你认识“女性压力性尿失禁”
- 200延长增粗方法众多,医生众说纷纭
- 200孩子,请走出手淫的阴影好吗?
- 200龟头炎的症状有哪些
- 199肾结石和输尿管结石患者术后出院
- 199强行中断性生活,害处多
- 199慢性前列腺炎患者自我调节
- 199谈谈慢性前列腺炎的药物治疗
- 199尿酸性肾结石患者饮食上需要注意
- 199训练法治疗早泄
热门泌尿外科