健康知识库
2014胰腺癌指南
编辑:ddayh.cn
- 200乳腺癌内分泌治疗
- 200副作用治疗
- 200胃癌患者术后注意事项
- 2002017年肺癌TNM分期
- 200非小细胞肺癌的四代EGFR-TKI靶向
- 200史上最全靶向治疗及免疫治疗大盘
- 200免疫治疗最全、最实用科普!
- 200肿瘤科普文章系列一:三分钟带你
- 200T-spot结核鉴别
- 200食品、补品或药品,都要一个度~
- 200癌症筛查怎么做
- 200每个人体内都有原癌基因和抑癌基
- 200乳腺的一生原来是这个样子的……
- 200你可能误会肿瘤了
- 200血友病是一种遗传性的,由于凝血
- 200腋下淋巴癌早期症状
- 200胃良性肿瘤如何鉴别诊断
- 200怎么样自我检查口腔癌
- 200产后得宫颈癌的原因有哪些
- 200胃窦癌症状和治疗方法
1 前言
据2014年最新统计数据显示,发达国家(美国)胰腺癌新发估计病例数,男性列第10位,女性列第9位,占恶性肿瘤死亡率的第4位。据《2013年中国肿瘤登记年报》统计,胰腺癌位列我国男性恶性肿瘤发病率的第8位,人群恶性肿瘤死亡率的第7位,全球范围内均呈快速上升趋势。
我国地域辽阔,各地经济及医疗水平差距较大,为了进一步规范胰腺癌的诊断与治疗,提高多学科综合诊治水平,中华医学会外科学分会胰腺外科学组结合近年来国内外在胰腺癌诊治领域的进展,对2007年制定的《胰腺癌诊治指南》进行修订,以更好地与国际指南及标准接轨,便于学术交流及总结。
推荐等级:
Category 1:有高级别证据支持,所有专家达成共识推荐;
Category 2A:有较低级别证据支持,所有专家达成共识推荐;
Category 2B:有较低级别证据支持,部分专家达成共识推荐;
Category 3:任何级别证据支持,存在较大争议。
除有特别标识,本指南均为Category 2A级别推荐。
胰腺癌的诊治建议至较大规模的诊疗中心并在多学科综合治疗团队( multidisciplinary team,MDT)的模式下进行,包括外科.影像、内镜、病理、肿瘤内科、介入、放疗等专业人员的参与,并贯穿病人诊治的全部过程。根据病人的基础健康状况、临床症状、肿瘤分期及病理类型,共同制定治疗计划,个体化地应用多学科及多种治疗手段,以使病人达到最佳的治疗效果。
本指南仅适用于胰腺导管上皮来源的恶性肿瘤(胰腺癌)。
2 胰腺癌的诊断与鉴别诊断
2.1胰腺癌的危险因素
包括吸烟、肥胖、酗酒、慢性胰腺炎等,接触萘胺及苯类化合物者罹患胰腺癌的风险显著增加。糖尿病是胰腺癌的风险因素之一,特别是老年、低体重指数、无糖尿病家族史的病人,新发2型糖尿病时应注意随访并警惕胰腺癌的可能。
胰腺癌具有遗传易感性,约10%的胰腺癌病人具有遗传背景,患有遗传性胰腺炎、Peutz-Jeghers综合征、家族性恶性黑色素瘤及其他遗传性肿瘤疾患的病人,胰腺癌的风险显著增加。
2.2诊断方法的选择
胰腺癌病人的主要症状包括上腹部不适、体重减轻、恶心、黄疸、脂肪泻及疼痛等,均无特异性。对临床上怀疑胰腺癌的病人和胰腺癌的高危人群,应首选无创性检查手段进行筛查,如血清学肿瘤标记物、超声、胰腺CT或MRI等。肿瘤标记物联合检测并与影像学检查结果相结合,可提高阳性率,有助于胰腺癌的诊断和鉴别诊断。
2.2.1肿瘤相关抗原
CA19-9可异常表达于多种肝胆胰疾病及恶性肿瘤病人,虽非为肿瘤特异性,但血清CA19-9的上升水平仍有助于胰腺癌与其他良性疾病的鉴别。作为肿瘤标记物,CA19-9诊断胰腺癌的敏感性为79%~81%,特异性为82%~90%。CA19-9水平的监测亦是判断术后肿瘤复发、评估放化疗效果的重要手段( Category 2B)。
约3%~7%的胰腺癌病人为Lewis抗原阴性血型结构,不表达CA19-9,故此类胰腺癌病人检测不到CA19-9水平的异常。某些良性疾患所致的胆道梗阻及胆管炎,亦可导致病人CA19-9水平的升高,故在黄疸缓解后检测CA19-9更有意义,以其作为基线值也更为准确( Category 3)。
其他肿瘤标记物包括CEA、CA50及CA242等,联合应用有助于提高诊断的敏感性及特异性。
2.2.2腹部超声
作为筛查手段,其可对梗阻部位、病变性质等做出初步评估。由于受胃肠道气体的干扰和操作者技术及经验水平的影响,敏感性及特异性不高,诊断价值有限。
2.2.3胰腺CT( panCreatiC protocol CT)
是疑有胰腺肿瘤病人的首选影像学检查。针对胰腺肿瘤应设置特别扫描参数,对全腹部行对比剂加强扫描,包括薄层(<3 mm)、平扫、动脉期、实质期、门静脉期及三维重建等,以准确描述肿瘤大小、部位及有无淋巴结转移特别是与周围血管的结构关系等。
2.2.4胰腺MRI( pancreatic protocol MRI)
与CT同等重要,参数要求同上。在排除及检测肝转移病灶方面,敏感性及特异性优于CT。
2.2.5内镜超声(EUS)
为CT及MRI的重要补充,可准确描述病灶有无累及周围血管及淋巴结转移,在诊断门静脉或肠系膜上静脉是否受累方面,敏感性及特异性优于对肠系膜上动脉的检测。EUS的准确性受操作者技术及经验水平的影响较大。
2.2.6PET/CT
其不可替代胰腺CT或MRI,作为补充,在排除及检测远处转移方面具有优势。对于原发病灶较大、疑有区域淋巴结转移及CA19-9显著升高的病人,推荐应用。
2.2.7腹腔镜探查
不建议常规应用。对于瘤体较大、疑有腹腔种植或远处转移的病人,可行腹腔镜探查,以避免不必要的开腹探查。
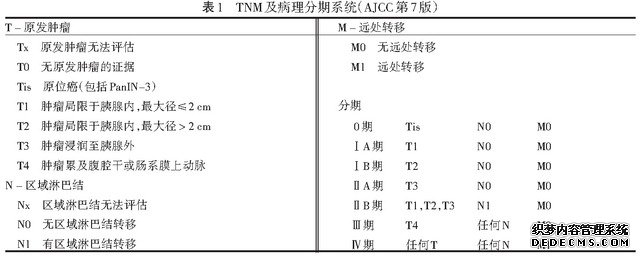
2.3胰腺癌分期见表1。
2.4术前病理学诊断
对于影像学诊断明确、具有手术指征的病人,行切除术前无需病理学诊断,亦不应囚等待病理学诊断而延误手术。对于拟行新辅助治疗或病灶不可切除拟行放化疗的病人,治疗前须明确病理学诊断。
获取组织或细胞行病理学诊断的途径包括超声或CT引导下经皮穿刺活检、ERCP胰液细胞刷取、EUS引导细针穿刺活检(EUS-FNA)等,首选EUS途径获取组织标本,其有效性、安全性高于其他途径,亦可避免经皮穿刺导致的出血、感染及针道种植等并发症。对于影像学表现典型而EUS-FNA活检阴性的病人,应再行EUS-FNA活检。
因该技术受操作者技术及经验影响较大,建议至有较大规模及经验的中心进行检查。对于术中探查为不可切除拟行姑息治疗的病人,须获取组织标本进行病理学诊断,以指导后续放化疗,可以切割针(core hiopsy)直接穿刺或经十二指肠穿刺活检,后者可避免囚穿刺导致的胰瘘。
对于临床及影像学表现不典型、细针穿刺活检阴性的病人,需注意与肿块型慢性胰腺炎及自身免疫性胰腺炎的鉴别,前者可行保留十二指肠的胰头切除术,后者多表现有血清IgG4升高,激素治疗有效。对于经多学科讨论,仍不能明确诊断或难以排除恶性的病人,在与病人及家属良好沟通的基础上,可行胰十二指肠切除术。
如相关辅助检查呈阴性表现,可排除恶性病变,但难以排除自身免疫性胰腺炎时,在密切观察下可尝试激素试验性治疗。
3 胰腺癌的外科治疗
3.1胰腺癌可切除性的评估标准
在MDT模式下,结合病人年龄、一般状况、临床症状、合并症、血清学及影像学检查结果,完成诊断及鉴别诊断,评估病灶的可切除性。
3.1.1可切除(resectable)
(1)无远处转移。(2)影像学检查显示肠系膜上静脉或门静脉形态结构正常。(3)腹腔动脉干、肝动脉、肠系膜上动脉周围脂肪境界清晰。
3.1.2可能切除(horderline resectable)
(1)无远处转移。(2)肠系膜上静脉或门静脉局限受累,狭窄、扭曲或闭塞,但其远近端正常,可切除重建。(3)肿瘤包裹胃十二指肠动脉或肝动脉局限性包裹,但未浸润至腹腔动脉干。(4)肿瘤紧贴肠系膜上动脉,但未超过180°。
3.1.3不可切除(unresectable)
(1)胰头癌:①远处转移。②肠系膜上动脉包裹>180°,肿瘤紧贴腹腔动脉干。③肠系膜上静脉或门静脉受累,不可切除重建。④主动脉或下腔静脉浸润或包裹。
(2)胰体尾癌:①远处转移。②肠系膜上动脉或腹腔动脉干包裹>180°。③肠系膜上静脉或门静脉受累,不可切除重建。④主动脉受浸润。
3.1.4淋巴结转移状况
手术切除范围以外存在淋巴结转移应视为不可切除。
3.2术前
胆道引流术前通过胆道引流缓解梗阻性黄疸,在改善病人肝功能、降低围手术期并发症发生率及病死率方面,其有效性及必要性存在争议。不建议术前常规行胆道引流。如病人合并发热及胆管炎等感染表现,建议术前行胆道引流,以控制感染,提高围手术期安全性。
根据技术条件,可选择内镜下经十二指肠乳头支架或经皮经肝胆道引流(PTCD)。如病人拟行新辅助治疗,合并黄疸者治疗前亦应置入支架缓解黄疸。如内镜支架为短期引流,建议置人塑料支架。
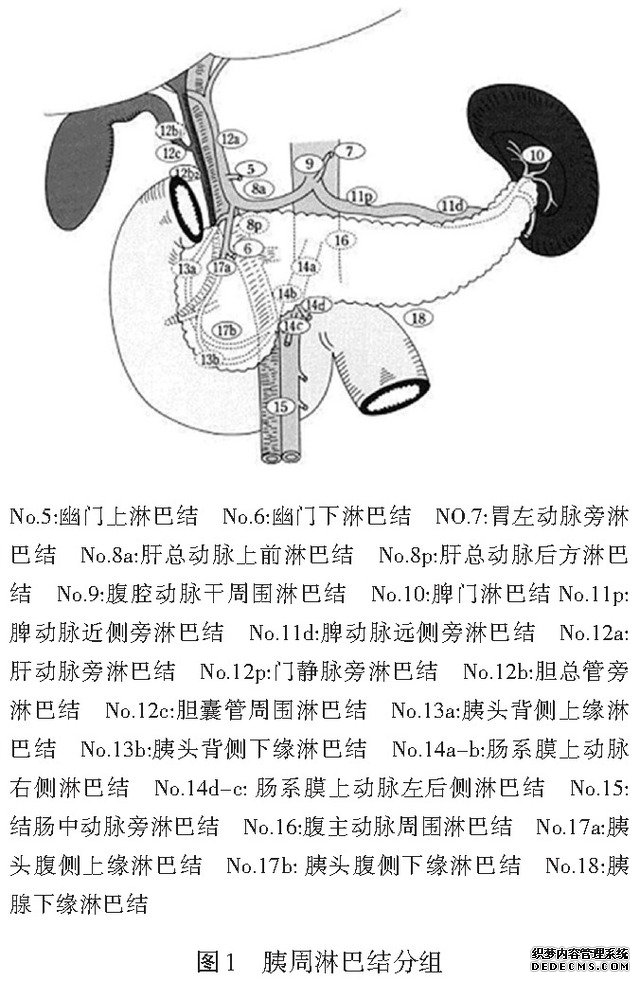
PTCD或内镜支架置入均可导致相关并发症,前者可致出血、胆漏或感染,后者可致急性胰腺炎或胆道感染,建议在较大规模的诊治中心完成上述诊疗行为。3.3胰头癌及胰体尾癌根治术的淋巴结清扫范围对于胰腺癌淋巴结分组,目前国内外文献及指南多以日本胰腺协会( Japanese Pancreas Society)的分组为命名标准,如图1所示。
热门肿瘤外科