健康知识库
脑室-腹腔分流手术过时了吗?北京天坛医院宫剑教授谈儿童颅内肿瘤合并梗阻性脑积水的治疗策略
编辑:ddayh.cn
- 上一篇:宫剑教授答疑解惑:宝宝的头型不正常,需要治疗吗?
- 下一篇:钛网颅骨修补外露率及原因
- 200硬膜下积液
- 200脑出血的前兆是什么
- 200GFAP
- 200颅内动脉瘤是什么?
- 200脑积水治疗 患上脑积水怎么办
- 200中风的识别和救治
- 200颅骨修补手术有什么风险
- 200穆苍山主任PEEK颅骨修复整形案例
- 200烟雾病缺血和出血的区别
- 199外伤伤口处理。
- 199癫痫的急救处理
- 199钛板修补颅骨怎么样,副作用大吗
- 199颅骨修补手术价格,颅骨修补peek
- 198脑动脉瘤患者出院后应该注意那些
- 198脑出血病人术后的护理
- 198一页一科普:医生,他还能醒过来
- 198失眠
- 198天津颈动脉堵塞哪个医院好
- 198唐氏综合征是什么?
- 198服用这12类药物后别喝酒!
 ?
?
?
1.儿童颅内肿瘤合并梗阻性脑积水治疗原则是什么?
儿童颅内肿瘤约57%位于中线部位,如鞍区(17%)、松果体区(8%)、第四脑室(20%)。肿瘤可直接阻塞脑脊液循环,不同部位的肿瘤合并梗阻性脑积水的概率高达20-80%1,2,使患儿受到肿瘤和脑积水的双重打击!
根据北京天坛医院小儿神外的诊疗规范,儿童颅内肿瘤合并梗阻性脑积水,首先要解除梗阻性脑积水,缓解高颅压危象,再从容治疗肿瘤。
2.治疗梗阻性脑积水有哪些手术方法?手术优缺点?
针对梗阻性脑积水,临床主要采取侧脑室-腹腔分流术和内镜下三脑室底部造瘘术。分流手术历经百余年的发展3,分流装置日臻完善,至今广泛应用于临床,特点是简便、安全、有效,缺点是体内异物植入;世界上第一台三脑室底部造瘘术是1923年通过输尿管镜完成的,具有现代意义的内镜下三脑室底部造瘘术则是在近二、三十年蓬勃发展,优点是无异物植入,缺点是脑积水复发率较分流术高4。由于三脑室底部造瘘手术是新兴手术,又避免了异物植入,失败后还能靠分流手术补救,因此,受到广大患儿家长的认同;但是,许多临床医生,对儿童颅内肿瘤合并梗阻性脑积水如何处理,缺乏统一认识,认为分流手术过时了,造瘘术才是先进的,无论何种病例都一味的采用造瘘手术,出现了很多问题,严重者甚至危及了患儿生命!
因此,有必要在此介绍一下北京天坛医院小儿神经外科针对儿童颅内肿瘤合并梗阻性脑积水的诊疗规范,供同道们参考。
?
3.请具体介绍一下:北京天坛医院小儿神经外科针对儿童颅内肿瘤合并梗阻性脑积水的诊疗规范
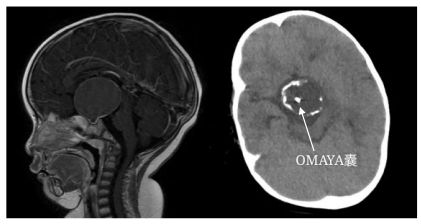
(1) 颅咽管瘤
巨大囊性颅咽管瘤合并梗阻性脑积水,患儿常出现急性高颅压症状甚至失明;建议急诊立体定向下OMAYA囊植入后抽吸囊液,可有效缓解脑积水并恢复视力;继而再择期从容的切除肿瘤;
 ?
?
?
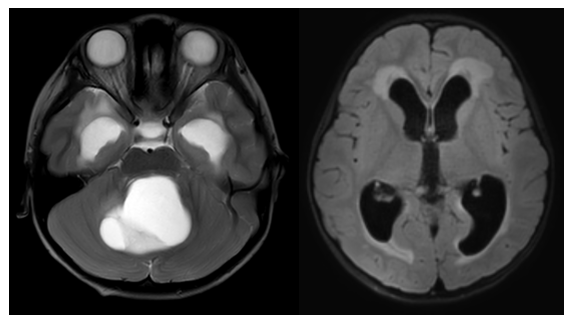
(2)后颅窝囊性星形细胞瘤
临床所见后颅窝巨大囊性星形细胞瘤合并梗阻性脑积水的患儿往往起病急,高颅压症状明显,甚至嗜睡朦胧。这种情况需要急诊行肿瘤囊腔穿刺,抽出肿瘤囊液10-20毫升后,患儿临床危象会明显缓解。再择期全切肿瘤,不需放化疗,患儿可以临床治愈。
 ?
?
?
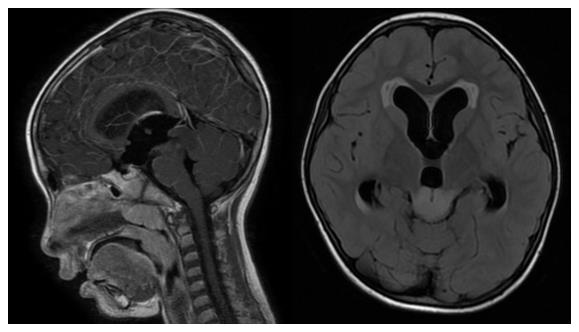
约10%的中脑导水管狭窄患儿合并顶盖星型细胞瘤5,该类肿瘤生长缓慢,大部分不需要手术治疗;若合并梗阻性脑积水出现高颅压症状,可采用内镜下三脑室底部造瘘手术解除脑积水,确切可靠。
 ?
?
?
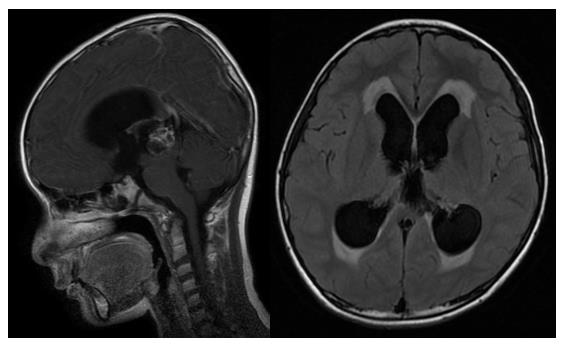
(4)松果体区生殖细胞瘤
通过临床资料:性别、年龄、肿瘤标记物、影像学的综合判断,高度怀疑松果体区生殖细胞瘤的患儿合并梗阻性脑积水,视脑积水严重程度而定:轻度无症状者,直接行诊断性放疗;中重度脑积水合并高颅压症状,先行内镜下三脑室底部造瘘确切缓解脑积水后再行后续治疗;松果体区生殖细胞瘤无需手术切除可以治愈!
 ?
?
?
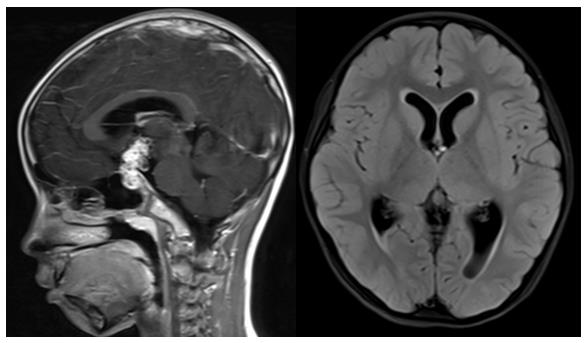
(5)鞍区生殖细胞瘤
通过临床资料:性别、年龄、肿瘤标记物、影像学的综合判断,高度怀疑鞍区生殖细胞瘤的患儿合并梗阻性脑积水,视脑积水严重程度而定:轻度无症状者,直接行诊断性放疗;中重度脑积水合并高颅压症状,先行侧脑室OMAYA囊植入,抽吸脑脊液缓解脑积水后,再行诊断性放疗;在后续治疗中,待瘤体缩小或消失,脑积水缓解后拔除OMAYA囊。鞍区生殖细胞瘤无需手术切除可以治愈,且体内不留异物!
 ?
?
?
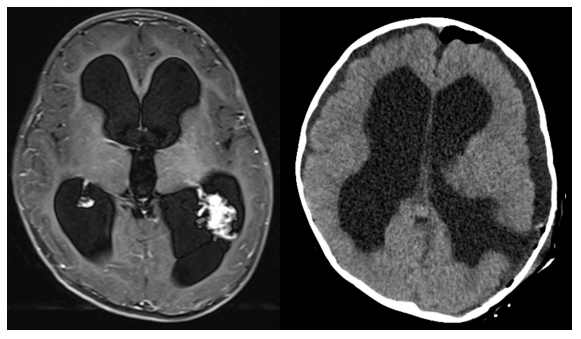
(6)脉络丛乳头状瘤
儿童脑室内脉络丛乳头状瘤多合并脑积水,与循环梗阻及瘤体过度分泌脑脊液有关,建议直接切除肿瘤。但是,约16%患儿会出现脑室穿通硬膜下张力性积液6,1岁以下患儿由于脑脊液分泌旺盛,蛛网膜颗粒重吸收能力不成熟7,8,建议行分流手术解除张力;1岁以上患儿可先试行三脑室底部造瘘术,若失败,再行分流手术补救。
 ?
?
?
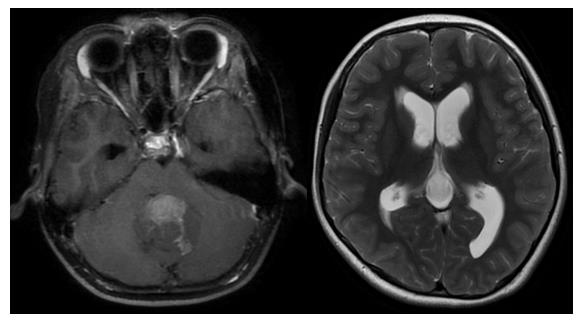
(7)中线区恶性肿瘤
儿童中线区常见的恶性肿瘤,如鞍区的视路胶质瘤,松果体区混合生殖细胞瘤,四室髓母细胞瘤或室管膜瘤等,若合并梗阻性脑积水,治疗周期长,环节多,需要格外重视!
 ?
?
?
依据北京天坛医院小儿神经外科诊疗规范,这类肿瘤全治疗周期包括:缓解脑积水-肿瘤全切或部分切除(视路胶质瘤)-放疗(髓母细胞瘤)或化放疗等。
有些学者提出一次性手术同时解决肿瘤和脑积水,这种治疗理念风险高:1.术中易出现急性脑膨出导致手术失败;2.?术后由于残渣、血凝块、止血材料的堵塞及术后放化疗致局部肿胀引起的急性脑积水再发生率高达30%,严重者危及生命。我们经常遭遇外院切除肿瘤后,放化疗期间突发脑积水昏迷,来天坛医院急诊抢救的病例。因此,北京天坛医院小儿神经外科作为全世界最大儿童颅内肿瘤手术治疗中心,不推荐此种治疗理念。
若首先解除脑积水,是选择三脑室底部造瘘术还是脑室-腹腔分流术?事实上,两种术式均可有效缓解梗阻性脑积水;但是,由于漏斗部位于三脑室脑脊液循环最低处,造瘘口易被后续切除肿瘤的手术残渣或血凝块堵塞,因此,三脑室底部造瘘术后脑积水再发生率高于脑室-腹腔分流术(33.3% vs 4.3%)4,造瘘失败的患者需要再次行分流术加以补救9。因此,除了视路胶质瘤只能先行分流手术,针对松果体区及后颅窝恶性肿瘤合并梗阻性脑积水,均建议先行分流手术加以缓解。
我们认为,分流术在后续肿瘤切除过程中全程发挥重要作用:术前将患者状态调至最佳,术中维持低颅压,术后能有效保障患者放化疗的安全。唯一的缺点是患儿体内植入异物,何时去除,我们也在不断摸索,前提是肿瘤要达到临床治愈。
需要指出,患儿在放化疗期间,常因脑组织顺应性变差致脑室扩张10,出现高颅压症状而急诊就诊。对于分流术后患儿,只需下调分流泵压力后继续放化疗;而对造瘘术后患儿,由于无法控制脑脊液循环的流量流速应对顺应性改变而只能再行分流手术,势必打断正常的放化疗周期,影响放化疗效果;严重者或因抢救不及时,失去继续放化疗的机会。
分流手术发展至今已历百年,长盛不衰,必有它的合理性;一味强调造瘘术无异物植入而抛弃分流手术不符合临床实际:若患儿已度过了高风险的手术关,却在后续放化疗期间因再发急性脑积水而死亡,着实可惜。分流手术恰恰可以将这一风险降至最低。
?
简而言之,对于中线区恶性肿瘤,在解除脑积水后还需要肿瘤切除及放化疗的患者,建议采取侧脑室-腹腔分流术。
?
5. 若先行分流手术会导致颅内恶性肿瘤腹腔播散种植吗?
关于颅内恶性肿瘤经分流管腹腔种植转移的问题,1954年-2017年,63年间全球报道可疑的经分流管播散转移者仅106例11;许多学者认为,颅内恶性肿瘤转移播散为自然过程,与分流管无关12。本人从事小儿神经外科二十余年,未见一例经分流管恶性脑瘤腹腔种植的患者。因此,这种潜在风险与分流管全程保护患者治疗所带来的巨大收益相比,不值一提!
?
6. 最后,请您对“分流手术过时了”这种观点做个评价?
我想先谈一下手术匠和外科医生的区别:手术匠是要能够保证外科手术的顺利完成,至于后续治疗周期再出现问题,不是手术匠所能预判和解决的;而外科医生一定要关心患儿全周期治疗过程,前期手术为后续辅助治疗提供充分的安全保障。在此,分流手术凸显出无可比拟的优势;若过分强调造瘘术无异物植入,而忽视它较高的脑积水再发率,显然是一个危险的误区!
?
总之,儿童颅内肿瘤合并梗阻性脑积水十分常见,不同肿瘤有不同的治疗策略,对于脑积水解除后还需要肿瘤切除及放化疗患者,大力推荐侧脑室-腹腔分流术先行缓解脑积水,不但没有过时,还将继续发挥决定性作用,造福广大患儿!
?
?
1. Koos WT, Horaczek A. Statistics of intracranial midline tumors in children. Acta neurochirurgica Supplementum. 1985;35:1-5.
2. Riva-Cambrin J, Detsky AS, Lamberti-Pasculli M, et al. Predicting postresection hydrocephalus in pediatric patients with posterior fossa tumors. Journal of neurosurgery Pediatrics. 2009;3(5):378-385.
3. Aschoff A, Kremer P, Hashemi B, Kunze S. The scientific history of hydrocephalus and its treatment. Neurosurgical review. 1999;22(2-3):67-93; discussion 94-65.
4. Kirkman MA, Hayward R, Phipps K, Aquilina K. Surgical decision-making in the management of childhood tumors of the CNS disseminated at presentation. Journal of neurosurgery Pediatrics. 2018;21(6):563-573.
5. Oka K, Kin Y, Go Y, et al. Neuroendoscopic approach to tectal tumors: a consecutive series. Journal of neurosurgery. 1999;91(6):964-970.
6. Pencalet P, Sainte-Rose C, Lellouch-Tubiana A, et al. Papillomas and carcinomas of the choroid plexus in children. Journal of neurosurgery. 1998;88(3):521-528.
7. Pan IW, Harris DA, Luerssen TG, Lam SK. Comparative Effectiveness of Surgical Treatments for Pediatric Hydrocephalus. Neurosurgery. 2018;83(3):480-487.
8. Zaben M, Manivannan S, Sharouf F, et al. The efficacy of endoscopic third ventriculostomy in children 1 year of age or younger: A systematic review and meta-analysis. European journal of paediatric neurology : EJPN : official journal of the European Paediatric Neurology Society. 2020.
9. El-Ghandour NM. Endoscopic third ventriculostomy versus ventriculoperitoneal shunt in the treatment of obstructive hydrocephalus due to posterior fossa tumors in children. Child's nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 2011;27(1):117-126.
10. Asai A, Matsutani M, Kohno T, et al. Subacute brain atrophy after radiation therapy for malignant brain tumor. Cancer. 1989;63(10):1962-1974.
11. Xu K, Khine KT, Ooi YC, Quinsey CS. A systematic review of shunt-related extraneural metastases of primary central nervous system tumors. Clinical neurology and neurosurgery. 2018;174:239-243.
12. Berger MS, Baumeister B, Geyer JR, Milstein J, Kanev PM, LeRoux PD. The risks of metastases from shunting in children with primary central nervous system tumors. Journal of neurosurgery. 1991;74(6):872-877.
?
?
热门神经外科