健康知识库
胰腺癌综合诊治指南(2018版)
编辑:ddayh.cn
- 200淋巴结越摸越多怎么办啊?
- 200做完手术后肚子上会留根管子,它
- 200男人乳房增大是要女性化还是长肿
- 200在等待入院手术期间应注意什么?
- 200体检发现甲状腺结节需要手术吗?
- 200被狗咬破了一点点皮,有必要打狂
- 200关于不明原因的瘙痒!!
- 200哪些药物引起尿色改变?
- 200细菌性肠炎怎么治疗
- 200血尿——泌尿系统疾病的“警示灯
- 200手脚冰凉是怎么回事?
- 200植皮手术后多久恢复
- 200你的朋友,焦虑症
- 199关于狂犬疫苗
- 199图说胆囊结石
- 199盲肠炎与阑尾炎的区别
- 199淋巴结炎的病因,症状,治疗及注
- 199你被宠物咬伤或者抓伤,什么情况
- 199肥胖增加患肿瘤风险
- 199经常有人问,我的胆囊结石很小的
【引用本文】中国抗癌协会胰腺癌专业委员会.胰腺癌综合诊治指南(2018版)[J].中华外科杂志,2018,56(7):481-494.
中国抗癌协会胰腺癌专业委员会
胰腺癌发病率呈快速上升趋势。2017年美国癌症协会发布的数据显示,美国胰腺癌新发病例数男性列第11位、女性列第8位,居恶性肿瘤死亡率第4位[1]。中国国家癌症中心最新统计数据也显示,胰腺癌位居中国城市男性恶性肿瘤发病率的第8位,居北京市和上海市人群恶性肿瘤死亡率的第5位[2,3]。
胰腺癌的诊治现状不容乐观,但在肿瘤学新理念的推动下临床诊疗水平已取得明显进步:(1)多学科协作诊疗模式(multidisciplinary team,MDT)得到普及,由多学科专家根据肿瘤临床及分子生物学特征,结合患者体能状况制定出个体化治疗方案,贯穿诊疗全程。(2)高通量测序技术联合系统生物学分析对胰腺癌进行分子分型,同时结合皮下或原位移植瘤动物模型开展药物敏感性的临床前研究,为胰腺癌"个体化诊疗"提供思路。(3)临床试验的开展和多中心跨区域合作为胰腺癌新药研发和治疗方案的优化提供了高级别循证医学证据,为改善患者预后提供参考。中国抗癌协会胰腺癌专业委员会结合中国国情制定了本指南,以期规范和提高我国胰腺癌诊治水平。
胰腺癌起病隐匿,早期症状不典型,常表现为上腹部不适、腰背部痛、消化不良或腹泻等,易与其他消化系统疾病相混淆。患者食欲减退,体重下降,出现症状时大多已属中晚期。
一、胰腺癌的危险因素
1.长期吸烟、高脂饮食、体重指数超标、过量饮酒、伴发糖尿病或慢性胰腺炎等是胰腺癌发病的危险因素[4,5,6]。
2.CDKN2A、BRCA1/2、PALB2等基因突变被证实与家族性胰腺癌发病密切相关[7,8]。
二、实验室检查
1.糖类抗原CA19-9是目前最常用的胰腺癌诊断标志物,具有以下临床特征:
将血清CA19-9>37 U/ml作为阳性指标,诊断胰腺癌的灵敏度和特异度分别达到78.2%和82.8%[9]。约10%的胰腺癌患者Lewis抗原阴性,CA19-9不升高,此时需结合其他肿瘤标志物如CA125和(或)癌胚抗原(carcinoembryonic antigen,CEA)等辅助诊断[10]。对于CA19-9升高者,在排除胆道梗阻或胆道系统感染等因素后应高度怀疑胰腺癌。
2.血糖变化也与胰腺癌发病或进展有关:
(1)老年、体重指数低、无糖尿病家族史的新发糖尿病者,应警惕胰腺癌的发生。(2)既往长期罹患糖尿病,短期出现血糖波动且难以控制者,亦应警惕胰腺癌的发生。(3)前瞻性研究结果显示,空腹血糖每升高0.56 mmol/L,胰腺癌发病风险增加14%[11]。
3.其他生物学靶点:
如外周血内microRNA、ctDNA、外泌体内Glypican-1等[12,13,14,15,16,17]也具有潜在临床应用前景,尚待高级别循证医学证据的证实。
三、影像学检查
影像学技术诊断胰腺癌的基本原则:(1)完整(显示整个胰腺);(2)精细(层厚1~3 mm的薄层扫描) ;(3)动态(动态增强、定期随访) ;(4)立体(多轴面重建,全面了解毗邻关系)。
1.增强三维动态CT薄层扫描是目前诊断胰腺癌最常用的手段[18],能清晰显示肿瘤大小、位置、密度及血供情况,并依此判断肿瘤与血管[必要时采用CT血管成像(computed tomography angiography,CTA)检查]、邻近器官的毗邻关系,指导术前肿瘤的可切除性及新辅助化疗效果评估。
2.MRI除显示胰腺肿瘤解剖学特征外,还可清晰地显示胰腺旁淋巴结和肝脏内有无转移病灶;且在与水肿型或慢性肿块型胰腺炎鉴别方面优于CT检查。磁共振胰胆管造影(magnetic resonance cholaniopancreatography,MRCP)与MRI薄层动态增强联合应用,有助于明确胰腺囊性和实性病变(尤其是囊腺瘤、胰腺导管内乳头状黏液肿瘤的鉴别诊断),并进一步明确胰管、胆管的扩张及侵犯情况,诊断价值更高[19]。
3.正电子发射断层显像(positron emission tomography,PET)-CT检查图像可显示肿瘤的代谢活性和代谢负荷[20],在发现胰外转移和评价全身肿瘤负荷方面具有明显优势。
4.超声内镜(endoscopic ultrasonography,EUS)在内镜技术的基础上结合了超声成像,提高了胰腺癌诊断的灵敏度和特异度[21];特别是EUS引导细针穿刺活检(fine needle aspiration,EUS-FNA),已成为胰腺癌定位和定性诊断最准确的方法[22]。另外,EUS也有助于判断肿瘤分期,诊断T1~2期胰腺癌的灵敏度和特异度分别为72%和90%,诊断T3~4期胰腺癌的灵敏度和特异度分别为90%和72%[23]。
四、病理学检查
组织病理学和(或)细胞学检查是诊断胰腺癌的"金标准"。除拟行手术切除的患者外,其余患者在制订治疗方案前均应力争明确病理学诊断。目前获得组织病理学或细胞学标本的方法包括:(1)EUS或CT引导下穿刺活检;(2)腹水脱落细胞学检查;(3)腹腔镜或开腹手术下探查活检。
根据WHO分类,胰腺恶性肿瘤按照组织起源可分为上皮来源和非上皮来源,其中上皮来源的肿瘤包括来自于导管上皮、腺泡细胞和神经内分泌细胞的导管腺癌、腺泡细胞癌和神经内分泌肿瘤及各种混合性肿瘤。本胰腺癌指南中主要针对导管腺癌[包括腺鳞癌、胶样癌(黏液性非囊性癌)、肝样腺癌、髓样癌、印戒细胞癌、未分化癌、伴有破骨样巨细胞的未分化癌等特殊亚型]和腺泡细胞癌。
随着一系列高通量分子病理学技术的应用,胰腺癌的分子分型(表1)为临床药物选择提供了一定参考[24,25,26,27,28,29,30,31]:如基因组不稳定型因合并BRCA通路突变或信号异常,被认为对铂类药物敏感[27];而免疫型因表达较多的肿瘤特异性抗原及存在相关免疫细胞浸润,可能从免疫治疗中获益[28]。然而受目前取材方式的限制和高通量检测过程耗时较长等因素的影响,分子分型尚不能常规开展并用于指导临床治疗[29],但胰腺癌分子分型的探讨可能会成为未来开展"个体化综合诊疗"的基础。
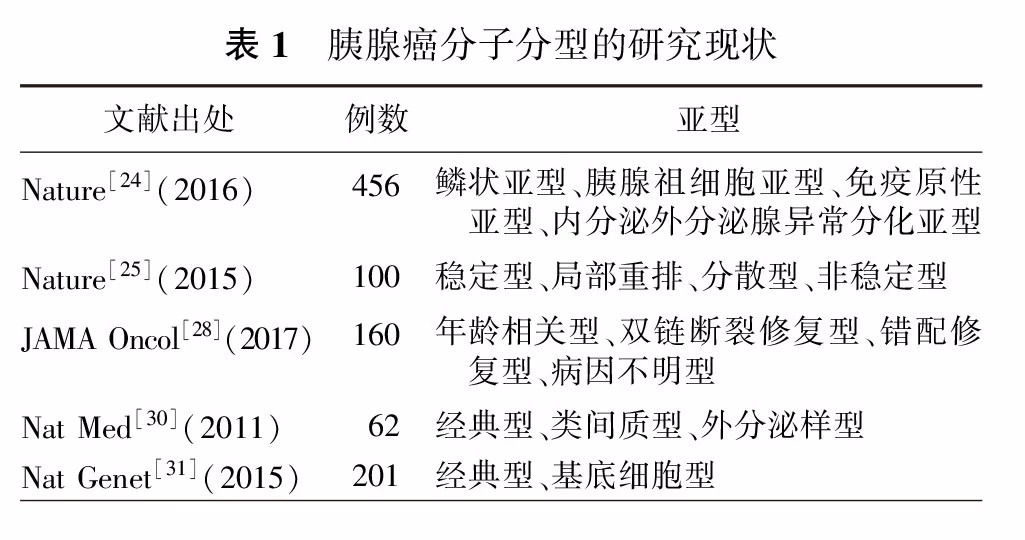
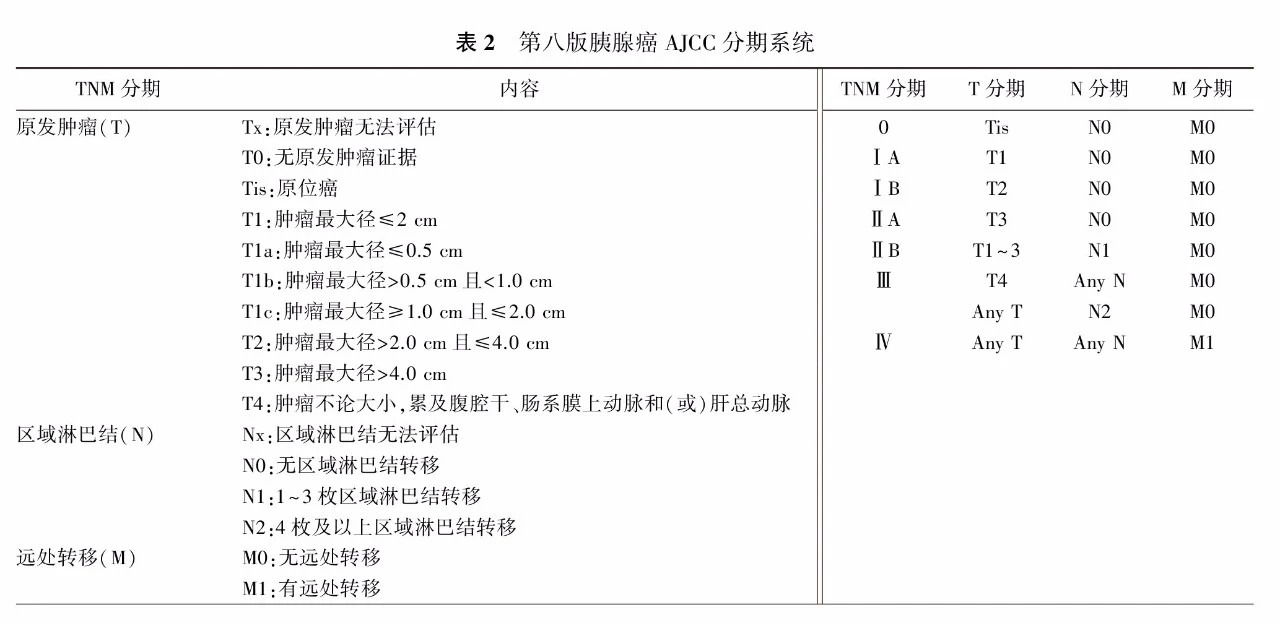
第八版AJCC分期系统中的胰腺癌TNM分期系统的实用性和准确性在我国多个中心的研究中获得验证(表2)[32,33]。但在如何更好地平衡分期系统中肿瘤大小与淋巴结转移的相关性,以及如何结合肿瘤生物学因素进行优化等方面,这一分期系统仍需要更深层次的探讨[33,34]。
根治性切除(R0)是目前治疗胰腺癌最有效的方法。术前应开展MDT讨论,依据影像学评估将胰腺癌分为可切除胰腺癌、交界可切除胰腺癌、局部进展期胰腺癌、合并远处转移的胰腺癌(表3)。

一、可切除胰腺癌的手术治疗
1.胰头癌:推荐根治性胰十二指肠切除术:(1)包括完整切除胰头部及钩突,并行区域淋巴清扫。要求胆管、胃或十二指肠、胰颈和肠系膜上动脉切缘阴性。(2)微创根治性胰十二指肠切除术在手术安全性、淋巴结清扫数目和R0切除率方面与开腹手术相当,但其"肿瘤学"获益性有待进一步的临床研究证实,推荐在专业的大型胰腺中心由有经验的胰腺外科医师开展[35]。
2.胰体尾癌:推荐根治性胰体尾联合脾脏切除术:(1)微创胰体尾切除术的手术安全性和根治性与开腹手术相比无差异,已获得较为广泛的应用与认可,但其"肿瘤学"获益性仍需进一步临床研究证实[36],推荐在专业的大型胰腺中心由有经验的胰腺外科医师开展。(2)根治性顺行模块化胰脾切除术在提高肿瘤R0切除率和淋巴清扫方面具有优势,但其对患者长期生存的影响有待临床研究证实[37]。
3.部分胰腺颈部癌或胰腺多中心病灶的患者,可考虑行全胰腺切除。此类患者的手术操作及围手术期处理更加复杂,推荐在专业的大型胰腺中心由有经验的胰腺外科医师开展。
4.扩大淋巴结清扫或神经丛切除,以及联合动静脉或多器官切除等扩大切除术对胰腺癌患者预后的改善存在争论,仍需要临床研究验证(胰腺癌标准根治与扩大切除术的手术范围见表4)。

二、交界可切除胰腺癌的手术治疗
1.交界可切除胰腺癌患者能否从手术中获益,目前尚缺乏足够的循证医学证据,建议进行临床研究。
2.新辅助治疗是目前交界可切除胰腺癌患者的首选治疗方式。部分交界可切除胰腺癌患者可从新辅助治疗中获益。对于新辅助治疗后序贯肿瘤切除的患者,联合静脉切除如能达到R0根治,则患者的生存获益与可切除患者相当。联合动脉切除对患者预后的改善存在争论,尚需前瞻性大样本的数据评价[38]。
3.不推荐这部分患者行姑息性R2切除,特殊情况如止血挽救生命除外。
三、局部进展期胰腺癌的手术治疗
1.对CT或EUS引导下反复穿刺活检仍无法明确病理学诊断的局部进展期胰腺癌患者,可行手术(腹腔镜或开腹)探查活检以明确病理学诊断。
2.合并胆道和消化道梗阻的局部进展期胰腺癌患者,优先考虑行内支架置入解除梗阻。当支架置入失败而患者体能状况尚可时,推荐开展胃-空肠吻合术或胆囊(或胆管)-空肠吻合术。
3.术中探查发现肿瘤无法切除但存在十二指肠梗阻的患者,应行胃-空肠吻合术;对尚未出现十二指肠梗阻、预期生存时间超过3个月的患者,仍建议行预防性胃-空肠吻合术;肿瘤无法切除而存在胆道梗阻,或预期可能出现胆道梗阻的患者,建议行胆总管(或肝总管)-空肠吻合术。
4.术中探查判定肿瘤无法切除的患者,在解除胆道、消化道梗阻同时,应尽量取得病理学诊断证据。
四、合并远处转移胰腺癌的手术治疗
1.不推荐合并远处转移的胰腺癌患者行减瘤手术。
2.部分合并远处孤立转移灶的胰腺癌患者经过系统化疗后,若肿瘤明显退缩且预计手术能达到R0切除,则推荐参加手术切除的临床研究[39]。
3.对于合并胆道及消化道梗阻的远处转移的胰腺癌患者,优先考虑行内支架置入解除梗阻。当支架置入失败且患者体能状态尚可时,才考虑开展姑息性旁路手术。
理论上胰腺癌患者化疗前均应获得细胞学或组织病理学证据,并行MDT讨论。化疗策略主要包括术后辅助化疗、新辅助化疗、局部进展期不可切除或合并远处转移患者的姑息性化疗等。
一、可切除胰腺癌的化疗原则
1.根治术后的胰腺癌患者如无禁忌证,均应行辅助化疗[40]。
2.辅助化疗方案推荐以吉西他滨或氟尿嘧啶类药物[包括卡培他滨、替吉奥、氟尿嘧啶(5-fluorouracil,5-FU)联合甲酰四氢叶酸钙]为主的单药治疗;体能状态较好的患者,建议联合化疗。常用方案见表5。

3.术后体能状态恢复较好的患者,辅助化疗起始时间尽可能控制在术后8周内[41],疗程达到6个疗程及以上[42]。
4.推荐针对具有高危因素的可切除胰腺癌患者开展新辅助化疗。高危因素包括:(1)较高水平的血清CA19-9;(2)较大的胰腺原发肿瘤;(3)广泛的淋巴结转移;(4)严重消瘦和极度疼痛等。2016年中国抗癌协会胰腺癌专业委员会多学科临床研究协作学组(Chinese Study Group For Pancreatic Cancer,CSPAC)专家共识推荐具有术前血清学特征"CEA异常升高、CA125异常升高、CA19-9≥1 000 U/ml"的可切除胰腺癌患者接受2~4个疗程的新辅助化疗[43]。
5.新辅助化疗后行根治手术且术后无复发或转移证据的可切除胰腺癌患者,建议MDT评估后继续开展辅助化疗,方案参考前期新辅助化疗的反应或临床研究结论。
二、交界可切除胰腺癌的化疗原则
1.交界可切除胰腺癌患者的治疗策略目前缺乏大型临床研究数据支持,建议开展相关临床研究。
2.体能状态良好的交界可切除胰腺癌患者,建议开展术前新辅助治疗;术后经MDT评估后再决定是否追加辅助化疗。辅助化疗方案参考对新辅助化疗的反应或临床研究结论(表6)。推荐根据患者的体能状态尽可能选择一线化疗方案。

3.经新辅助治疗后仍无法手术切除的患者,依据晚期胰腺癌的化疗原则继续化疗(表7)。
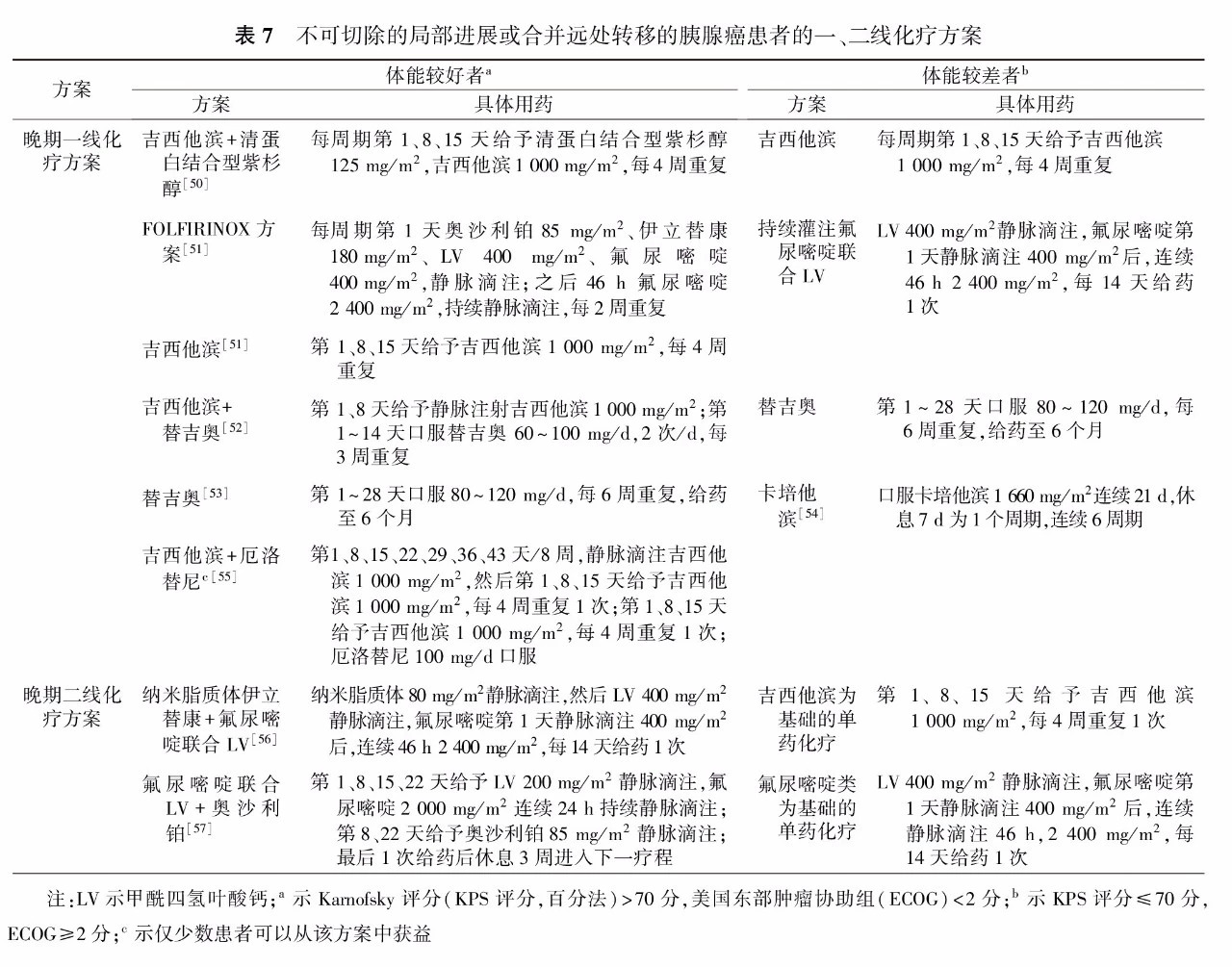
三、不可切除的局部进展期或合并远处转移的胰腺癌的化疗原则
1.不可切除的局部进展期或合并远处转移的胰腺癌总体治疗效果不佳,建议开展相关临床研究。
2.推荐不可切除的局部进展期或合并远处转移的胰腺癌患者,依据体能状态选择一线化疗方案开展化疗(表7)。
3.一线化疗后出现进展的胰腺癌可依据已使用过的药物、患者合并症和不良反应等选择非重叠药物开展二线化疗。二线化疗比最佳支持治疗更有效[47]。对于具有微卫星不稳定性(Microsatellite instability,MSI)或错配修复(mismatch repair,MMR)特征的胰腺癌,在二线治疗中可考虑联合使用PD-1抗体[48,49]。
4.一、二线化疗方案失败后的胰腺癌患者是否继续开展化疗存在争议,尚无明确化疗方案,建议开展临床研究。
一、基本共识
1.对胰腺癌患者是否进行放疗需要由MDT综合评估后决定。由于胰腺癌的放射抵抗性较高,且相邻空腔脏器不能耐受高剂量放射,因此,不能给予胰腺癌患者根治性的高剂量放疗。对大多数胰腺癌而言,放疗是一种局部的姑息治疗。
2.放疗必须与化疗相联合;放疗期间的同步化疗常将吉西他滨或氟尿嘧啶类药物[52]作为放射增敏剂使用;同时放疗前可行诱导化疗或放疗后行辅助化疗。
3.术前新辅助放化疗对交界可切除胰腺癌效果的研究目前正在进行中,尚无高级别循证医学证据[58,59]。
4.放疗在局部进展期胰腺癌中的地位虽然得到业界多数学者的认可,但尚未被前瞻性临床随机对照研究证实。EUS引导下的胰腺癌瘤体内放射性粒子植入的内照射技术对于镇痛有一定疗效,但患者的生存获益尚未证实[60,61]。
5.对合并远处转移的胰腺癌,放疗作为姑息治疗,对缓解胰腺癌引起的腹背疼痛有一定疗效。
二、治疗原则
1.可手术切除和交界可切除胰腺癌的新辅助放化疗:
(1)存在以下高危因素的该类患者可考虑行新辅助放化疗:①肿瘤累及胰腺被膜外;②肿瘤侵犯肠系膜血管;③CA19-9≥1 000 U/ml等。(2)新辅助放化疗可增加手术切除率和阴性切缘比例,但无特定的新辅助放化疗方案[62,63]。目前推荐2~6个疗程诱导化疗后,行5-FU/吉西他滨为基础的同期放化疗[63]。(3)推荐新辅助放化疗后4~8周进行手术,但放疗所致的纤维化可使手术难度增加。(4)新辅助放化疗时,放疗总剂量为45.0~50.4 Gy,1.8~2.0 Gy/次,每周照射5次,也可使用总剂量36 Gy,2.4 Gy/次,每周照射5次。
2.胰腺癌手术切除后的放疗:
(1)不推荐根治术后常规进行辅助放疗。(2)具有以下高危复发因素的该类患者可考虑行术后辅助放疗:①淋巴结转移,特别是淋巴结包膜外浸润;②切缘阳性(R1);③局部有病灶残留(R2)[64]。(3)照射范围包括肿瘤床、吻合口及邻近淋巴结引流区。但胆肠吻合口和胃空肠吻合口尽量避免照射。(4)放疗总剂量为45.0~50.4 Gy,分割剂量1.8~2.0 Gy/次,高复发危险部位可加量5.0~9.0 Gy[65]。
3.局部进展期胰腺癌的同期放化疗:
(1)符合以下要求的该类患者可考虑行同期放化疗:①局部进展期胰腺癌;②一般情况好(ECOG 0~1)。(2)推荐行4~6个疗程的诱导化疗后,再次对肿瘤状态进行评估:①对无远处转移的患者进行同期放化疗或立体定向放射治疗(stereotactic body radiation therapy,SBRT)[66],②诱导化疗期间若胰腺肿瘤局部进展,但只要没有发生远处转移,仍推荐进行同期放化疗。(3)同期放化疗的方案建议:①卡培他滨或替吉奥联合放疗[67],②常规分割放疗,1.8~2.0 Gy/次,每周5次,总剂量为45~54 Gy。如果肿瘤距离空腔器官足够远,在不超过这一器官耐受剂量的前提下,放疗总剂量可以>54 Gy。(4)不推荐肿瘤累及肠道或胃壁的患者接受SBRT。(5)SBRT的总剂量和分割剂量尚无明确的标准,目前推荐的分割剂量为30~45 Gy/3次,或25~45 Gy/5次。(6)无法耐受化疗的患者可尝试单纯放疗。(7)存在梗阻性黄疸的患者,放疗开始前需要行胆道引流,待黄疸消退后再开始放疗。
4.手术后局部肿瘤和区域淋巴结复发的放化疗:
对未接受过放疗的患者,建议化疗后同步放化疗。放疗剂量一般为45~54 Gy,每次剂量为1.8~2.0 Gy。
5.姑息放疗[68]:
(1)胰腺癌患者常伴的严重腹背疼痛。对于使用吗啡仍不能缓解疼痛的患者;或由于使用大剂量吗啡而无法耐受便秘等严重不良反应的患者,可以使用姑息放疗镇痛。(2)即使合并远处转移的胰腺癌,也可以使用姑息性放疗缓解疼痛[69]。放疗剂量为25~36 Gy,分割剂量为2.4~5.0 Gy/次。(3)对由转移性病变引起的局部剧烈疼痛如骨转移,也可以给予姑息放疗。总剂量为30 Gy/10次。
一、介入治疗
动脉内灌注化疗治疗胰腺癌的效果存在争议[70,71],建议进行临床研究。但需注意介入治疗的适应证和禁忌证(表8)。临床操作中建议如下:(1)若见肿瘤供血动脉,超选后灌注化疗。(2)若未见肿瘤供血动脉,建议胰头、胰颈部肿瘤经胃十二指肠动脉灌注化疗;而胰体尾部肿瘤则根据肿瘤范围、血管造影情况,经腹腔动脉、肠系膜上动脉或脾动脉灌注化疗。(3)对于伴有肝转移者经肝固有动脉灌注化疗,若造影见肝内转移灶血供丰富,可联合栓塞治疗。

二、最佳支持治疗
提高胰腺癌患者的生活质量是最佳支持治疗的重要目的。
1.阿片类制剂是控制胰腺癌疼痛的主要药物。若阿片类药物不能控制疼痛或导致不能耐受的不良反应,推荐使用神经丛切断、EUS引导下的神经丛消融术(celiac plexus neurolysis,CPN)或无水酒精注射。
2.营养不良甚至恶液质在终末期胰腺癌患者中较多见。首先应对患者进行恶液质的诊断与分期[72];其次在判定全身营养状况和患者胃肠道功能状况基础上制订营养治疗计划:(1)生命体征平稳而自主进食障碍者,推荐营养支持治疗。(2)生命体征不稳和多器官功能衰竭者原则上不考虑系统性营养支持治疗。(3)酌情选用能够逆转恶液质异常代谢的代谢调节剂,目前使用的药物包括鱼油不饱和脂肪酸、二十二碳六烯酸和沙利度胺等。
3.对于严重癌性腹水的患者,推荐留置腹腔引流管;同时可以尝试腹腔热灌注疗法。
4.对于胰腺外分泌功能不足,进而引起营养物质吸收障碍者,可用胰酶替代治疗。
三、中医中药治疗
中医药治疗胰腺癌的循证医学证据不多,需要积极开展临床多中心试验研究。
四、其他治疗及其进展
主要包括去间质治疗、分子靶向治疗、免疫治疗等,目前多在临床试验阶段。
1.去间质治疗:目前仍处于临床试验阶段[73,74,75],疗效尚不确定。
2.靶向治疗:目前推荐厄洛替尼联合吉西他滨用于局部进展或者合并远处转移的胰腺癌的治疗,但临床疗效不佳[76]。在德国的一项Ⅱb期多中心临床试验中,尼妥珠单抗联合吉西他滨显示了较好的疗效(总生存时间由6.0个月延长至8.6个月,P=0.034 1),尤其是对EGFR高表达和KRAS野生型的局部进展或合并远处转移的胰腺癌患者(1年生存率分别为36.4%和53.8%)[7],但结果仍有待Ⅲ期临床试验的进一步验证。其他靶向治疗药物的疗效尚待评价。
3.免疫治疗:PD-1单克隆抗体pembrolizumab对高度微卫星不稳定性(MSI-H)或缺失错配修复(dMMR)的肿瘤患者具有较好的疗效。目前推荐用于具有MSI或MMR分子特征的合并远处转移的胰腺癌患者,但需要高级别循证医学证据的支持。
4.不可逆性电穿孔又称纳米刀。该技术2011年被美国食品和药物管理局批准应用于临床,主要针对局部进展期胰腺癌患者[78]。2015年被中国食品药品管理协会批准用于胰腺癌和肝癌的治疗。该技术的安全性和有效性尚需临床研究结果证实。
一、不能确诊为胰腺癌的患者的随访安排
临床怀疑胰腺癌,但难以与自身免疫性胰腺炎、慢性胰腺炎等疾病鉴别诊断时,应对患者进行密切随访。随访项目包括CT、MRI等影像学检查和CA19-9、CA125、CEA等血清肿瘤标志物检查,必要时可重复行EUS穿刺活检和(或)PET-CT检查。推荐随访时间为每2~3个月1次。
二、中早期胰腺癌患者的随访安排
胰腺癌患者术后第1年,建议每3个月随访1次;第2~3年,每3~6个月随访1次;之后每6个月随访1次。随访项目包括血常规、生化指标、CA19-9、CA125、CEA等血清肿瘤标志物,超声、X线、胸部薄层CT扫描、上腹部增强CT等。随访时间至少5年。怀疑肝转移或骨转移的患者,加行肝脏MRI和骨扫描。
三、晚期胰腺癌患者的随访安排
晚期或合并远处转移的胰腺癌患者,应至少每2~3个月随访1次。随访包括血常规、生化指标、CA19-9、CA125、CEA等血清肿瘤标志物,胸部CT、上腹部增强CT等检查,必要时复查PET-CT。
随访的目的是综合评估患者的营养状态和肿瘤进展情况等,及时调整综合治疗方案。
一、胰腺癌诊疗过程中MDT的重要性?
原则上在有条件的中心,胰腺癌患者的诊断及治疗各个阶段均应开展MDT讨论,由多学科专家(胰腺外科、消化内科、肿瘤内科、放疗科、影像科、病理科、介入科、营养科等)共同制定诊治方案并贯彻始终。
二、胰腺癌病理诊断过程中如何选择活检部位?
1.无远处病灶的"胰腺占位",病理取材部位是胰腺原发病灶。
2.高度怀疑合并远处转移的"胰腺占位",取材部位可选转移病灶,如肝脏病灶。
三、关于胰腺癌临床诊断标准的制定?
鉴于胰腺特殊的解剖位置和胰腺癌特殊的生物学性状,部分高度怀疑胰腺癌却无法获得明确细胞学或组织学证据的患者,在接受MDT讨论后,可慎重做出临床决策,开展合理治疗[79]。推荐做到以下几点。
1.具有完善的临床资料,包括全面、多次的血清学和各项影像学检查。
2.专业介入或内镜医师反复穿刺活检,并由经验丰富的多名病理科医师集中会诊。
3.与患者及家属多次沟通,获得知情同意。
4.由MDT讨论共同制定最终决策,治疗过程中严密监测。
四、如何进行胰腺癌的可切除性评估?
1.推荐行增强的三维CT薄层扫描,甚至EUS,对胰腺癌局部侵犯程度进行评估。
2.推荐通过CT和(或)MRI对肿瘤远处转移情况进行评估。
3.临床高度怀疑远处转移但CT和MRI检查结果无法证实的患者,推荐行PET-CT扫描或腹腔镜探查。
五、在专业大型胰腺中心进行胰腺癌根治术的必要性?
与小型中心相比,大型专业中心实施的胰腺癌根治术具有更低手术并发症发生率和围手术期病死率,因此,推荐由大型专业中心由经验丰富的医师主持开展胰腺癌根治术及相关诊疗措施。
六、胰腺癌根治术前是否需要减黄治疗?
1.术前胆道引流解除梗阻性黄疸的必要性尚存在争论[80,81]。
2.高龄或体能状态较差的患者,若梗阻性黄疸时间较长,合并肝功能明显异常、发热及胆管炎等感染表现,推荐术前行减黄治疗。
3.术前拟行新辅助治疗的患者,亦应首先行减黄治疗。
七、如何选择合理有效的减黄方式?
1.拟行根治性手术的患者推荐ERCP下鼻胆管或塑料支架置入,或经皮经肝胆管引流(percutaneous transhepatic cholangial drainage,PTCD)。拟行微创胰十二指肠切除术的患者,建议行PTCD减黄。
2.对于局部进展期不可切除胰腺癌或合并远处转移者,推荐行ERCP下金属支架置入术。
3.合并上消化道狭窄、梗阻,或曾行消化道重建手术等不能开展ERCP下支架置入的梗阻性黄疸患者,或ERCP下支架减黄失败的患者,推荐PTCD。
八、关于微创手术在胰腺癌中的应用?
1.微创胰十二指肠切除术手术安全性近年来不断提高,但作为一种复杂、高风险手术,需要较长时间的学习曲线和手术量的积累。其"肿瘤学"获益仍需进一步验证。推荐开展临床研究或在大型专业的胰腺中心由有经验的胰腺外科医师实施此类手术。
2.微创胰体尾切除术微创优势明显,在国内外广泛应用,手术安全性与开腹手术相比无差异,但其"肿瘤学"获益仍需高级别循证医学证据证实。推荐参加临床研究或在专业的大型胰腺中心由有经验的胰腺外科医师实施手术。
3.对可疑局部不可切除和(或)可疑远处转移的胰腺癌患者,推荐开展腹腔镜探查。腹腔镜探查可发现腹膜和肝脏等器官表面的微小转移,并可切取活检,弥补目前影像学检查无法精确判断分期的不足,具有诊断和判断分期的价值,推荐剖腹手术前积极开展。如结合腹腔镜超声检查,有助于详细了解肿瘤与血管的关系,判断肿瘤可切除性。
九、如何对手术标本或手术切缘进行标记和取材?
1.应在术者或第一助手指导下完成标本淋巴结的获取、命名和分装。
2.应由术者和病理科医师共同对标本各切缘进行标记和描述。如术中联合门静脉或肠系膜上静脉切除,则应对静脉受累情况分别取材送检,并根据浸润深度做详细分类(表9)。

3.推荐将距切缘1 mm内无肿瘤细胞浸润定义为R0切除;距切缘1 mm组织内有肿瘤细胞浸润定义为R1切除;肉眼可见的肿瘤残留定义为R2切除。
十、扩大切除能否提高胰腺癌手术疗效?
1.目前尚无明确的胰腺癌扩大切除指征,推荐开展多中心临床研究。
2.扩大切除的基本要求是做到R0或R1切除,不推荐开展R2切除术。
3.推荐开展能达到R0切除标准的联合门静脉或肠系膜上静脉切除,否则不建议实施这一扩大手术方式。
4.扩大淋巴结清扫或神经丛切除对患者长期生存的影响存在争论,尚需临床研究证实。
5.针对交界可切除和局部进展期患者,转化治疗后扩大切除较姑息性治疗更能带来生存获益。
十一、标准胰头癌根治术中是否联合第16组淋巴结清扫?
2016年CSPAC专家共识不推荐具备以下特征的胰头癌患者进行第16组淋巴结清扫:(1)肿瘤为交界可切除。(2)术前高血清肿瘤负荷(CEA异常升高、CA125异常升高、CA19-9 ≥1 000 U/ml)。(3)第16组淋巴结呈弥漫性转移。
十二、血清肿瘤标志物能否预测胰腺癌手术切除率并判断预后?
血清肿瘤标志物如CA19-9可以在影像学检查基础上提示并预测手术效果,但其准确性仍需要大规模临床研究来证实[82,83]。目前证据表明:
1.术前血清CA19-9水平越高,胰腺癌手术切除率越低。
2.手术前后血清CA19-9变化与患者术后生存密切相关。术后CA19-9水平对手术疗效的预测较术前更有价值,术后CA19-9降至正常的患者预后较好。
3.血清肿瘤标志物CA125和胰腺癌转移密切相关,对胰腺癌可切除性的预测有重要价值。
4.对Lewis抗原阴性和CA19-9不表达的胰腺癌患者,CA125联合CEA有助于预测这部分患者的预后。
十三、是否推荐可切除胰腺癌患者接受术前新辅助治疗?
1.新辅助治疗对可切除胰腺癌患者预后的影响已获得高度重视,但还缺乏高级别循证医学证据,建议积极开展临床研究。
2.建议针对具有高危因素如:(1)较高水平的血清CA19-9;(2)较大的胰腺原发肿瘤;(3)广泛淋巴结转移;(4)严重消瘦和极度疼痛等的患者进行新辅助治疗。2016年CSPAC专家共识推荐具有术前血清学特征"CEA异常升高、CA125异常升高、CA19-9≥1 000 U/ml"的可切除胰腺癌患者接受2~4个疗程的新辅助化疗[84,85]。
十四、RECIST标准是否能在胰腺癌根治术前反映新辅助治疗疗效?
1.由于胰腺癌富含间质,基于影像学RECIST标准的术前评估不能全面反映胰腺癌新辅助治疗疗效。
2.新辅助治疗前后血清CA19-9的变化对提示新辅助治疗疗效具有重要价值。
十五、血清或组织学分子标记能否预测胰腺癌化疗疗效?
1.血清CA19-9水平及其变化对化疗疗效的预测有重要价值,但还需要更高级别的循证医学证据。目前几项研究结果可以作为参考:(1)术后血清CA19-9<90 U/ml的胰腺癌患者辅助化疗后无瘤生存时间显著延长,而术后血清CA19-9水平>90 U/ml的患者不能从辅助化疗中获益。(2)接受新辅助化疗的交界可切除患者,新辅助化疗后血清CA19-9≤40 U/ml者术后可获得较长的生存时间。(3)晚期胰腺癌患者,治疗前血清CA19-9水平可以独立判断预后。
2.检测根治术后胰腺癌组织样本内的人类平衡型核苷转运载体1(human equilibrative nucleoside transporter 1,hENT1)表达水平,可预测术后吉西他滨辅助化疗的疗效——hENT1高表达者对吉西他滨更加敏感,治疗后中位生存时间较低表达者显著延长。
3.检测新辅助治疗前胰腺癌组织样本内羧酸酯酶2表达,可预测交界可切除患者对新辅助FOLFIRINOX方案的灵敏度[86]。
十六、一线或二线化疗失败后的胰腺癌患者是否继续开展系统性治疗?
推荐一线或二线化疗失败后体能状态较好的局部晚期,复发性,或合并远处转移的胰腺癌患者继续开展系统性治疗。药物选择无固定方案,建议开展临床研究或通过基因检测为临床用药提供参考。
十七、如何定义不可切除胰腺癌中化疗应用的时间期限?
推荐化疗持续应用于不可切除胰腺癌(包括肿瘤局部进展不可切除、复发性或合并远处转移),除非肿瘤明显进展或药物毒性限制其继续使用。
十八、对于局部进展期不可切除的胰腺癌,化疗及放化疗如何结合更为有效?
局部进展期不可切除的胰腺癌,首先推荐化疗序贯放化疗的治疗策略。
十九、胰腺癌患者治疗过程中是否推荐术中放疗?
1.不推荐在胰腺癌根治术中同期开展术中放疗。
2.术中放疗应用于局部进展期不可切除胰腺癌的临床有效性已得到多数研究证实,推荐在有条件的中心开展。
组长:赵玉沛(中国医学科学院北京协和医学院北京协和医院)
组员(按姓氏汉语拼音排序):巴一(天津医科大学肿瘤医院)、白永瑞(上海交通大学医学院附属仁济医院)、蔡秀军(浙江大学医学院附属邵逸夫医院)、陈汝福(中山大学孙逸仙纪念医院)、窦科峰(空军军医大学西京医院)、杜奕奇(上海长海医院)、傅德良(复旦大学附属华山医院)、韩国宏(空军军医大学西京医院)、郝继辉(天津医科大学肿瘤医院)、蒋国梁(复旦大学附属肿瘤医院)、金钢(上海长海医院)、金政锡(黑龙江省医院)、李宏为(上海交通大学医学院附属瑞金医院)、李进(同济大学附属东方医院)、李升平(中山大学附属肿瘤医院)、李文涛(复旦大学附属肿瘤医院)、梁廷波(浙江大学医学院附属第二医院)、廖泉(中国医学科学院北京协和医学院北京协和医院)、刘颖斌(上海交通大学医学院附属新华医院)、刘续宝(四川大学华西医院)、苗毅(江苏省人民医院)、牟一平(浙江省人民医院)、倪泉兴(复旦大学附属肿瘤医院)、彭卫军(复旦大学附属肿瘤医院)、彭淑牖(浙江大学医学院附属第二医院)、全志伟(上海交通大学医学院附属新华医院)、秦仁义(华中科技大学同济医学院附属同济医院)、邵成浩(上海长征医院)、沈柏用(上海交通大学医学院附属瑞金医院)、沈琳(北京大学肿瘤医院)、盛伟琪(复旦大学附属肿瘤医院)、孙备(哈尔滨医科大学附属第一医院)、田伯乐(四川大学华西医院)、王春友(华中科技大学同济医学院附属协和医院)、王成锋(中国医学科学院肿瘤医院)、王俭(上海长征医院)、王理伟(上海交通大学医学院附属仁济医院)、王巍(复旦大学附属华东医院)、杨秀疆(复旦大学附属肿瘤医院)、杨尹默(北京大学第一医院)、虞先濬(复旦大学附属肿瘤医院)、湛先保(上海长海医院)、章真(复旦大学附属肿瘤医院)、朱雄增(复旦大学附属肿瘤医院)
执笔专家:虞先濬、刘亮、徐华祥、武春涛、李浩
参考文献 略
热门普外科